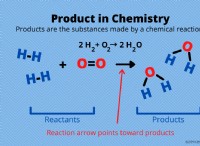
Πώς μπορεί η συγκόλληση να καθορίσει τις ιδιότητες μιας απάντησης ουσίας;
1. Φυσικές ιδιότητες:
* Σημεία τήξης και βρασμού:
* Ιονικά ομόλογα: Υψηλά σημεία τήξης και βρασμού λόγω ισχυρής ηλεκτροστατικής έλξης μεταξύ των ιόντων.
* ομοιοπολικοί δεσμοί: Μεταβαλλόμενα σημεία τήξης και βρασμού ανάλογα με την αντοχή των δεσμών. Οι ισχυροί ομοιοπολικοί δεσμοί (όπως στα διαμάντια) οδηγούν σε υψηλά σημεία τήξης, ενώ οι ασθενέστεροι ομοιοπολικοί δεσμοί (όπως στο μεθάνιο) έχουν χαμηλότερα σημεία τήξης.
* Μεταλλικοί δεσμοί: Υψηλά σημεία τήξης και βρασμού λόγω των απομακρυσμένων ηλεκτρονίων που σχηματίζουν μια ισχυρή "θάλασσα ηλεκτρονίων".
* σκληρότητα:
* Ιονικά ομόλογα: Γενικά σκληρά και εύθραυστα λόγω ισχυρών ηλεκτροστατικών αλληλεπιδράσεων.
* ομοιοπολικοί δεσμοί: Η σκληρότητα εξαρτάται από τον τύπο του ομοιοπολικού δικτύου. Το Diamond, με ένα ισχυρό δίκτυο 3D, είναι εξαιρετικά σκληρό, ενώ ο γραφίτης, με στρωματοποιημένες δομές, είναι μαλακό.
* Μεταλλικοί δεσμοί: Γενικά ισχυρά και εύπλαστα λόγω της ευελιξίας του ηλεκτρονίου "SEA".
* αγωγιμότητα:
* Ιονικά ομόλογα: Διεξάγετε ηλεκτρικό ρεύμα μόνο σε λιωμένες ή διαλυμένες καταστάσεις όταν τα ιόντα μπορούν να κινούνται ελεύθερα.
* ομοιοπολικοί δεσμοί: Γενικά, οι κακοί αγωγοί, εκτός από τον γραφίτη όπου τα απομακρυσμένα ηλεκτρόνια επιτρέπουν την αγωγιμότητα.
* Μεταλλικοί δεσμοί: Εξαιρετικοί αγωγοί θερμότητας και ηλεκτρικής ενέργειας λόγω της ελεύθερης κίνησης των ηλεκτρονίων.
* Διαλυτότητα:
* Ιονικά ομόλογα: Συχνά διαλυτά σε πολικούς διαλύτες (όπως το νερό) λόγω αλληλεπιδράσεων ιόντων-διαδρομών.
* ομοιοπολικοί δεσμοί: Η διαλυτότητα εξαρτάται από την πολικότητα του μορίου. Τα πολικά ομοιοπολικά μόρια διαλύονται σε πολικούς διαλύτες και τα μη πολικά ομοιοπολικά μόρια διαλύονται σε μη πολικούς διαλύτες.
* μεταβλητότητα:
* Ιονικά ομόλογα: Γενικά χαμηλή μεταβλητότητα (μην εξατμίζεται εύκολα) λόγω ισχυρών ηλεκτροστατικών αλληλεπιδράσεων.
* ομοιοπολικοί δεσμοί: Η μεταβλητότητα μπορεί να ποικίλει. Οι αδύναμοι ομοιοπολικοί δεσμοί οδηγούν συχνά σε υψηλή μεταβλητότητα (όπως στις πτητικές οργανικές ενώσεις).
2. Χημικές ιδιότητες:
* Αντιδραστικότητα:
* Ιονικά ομόλογα: Συχνά αντιδρούν εύκολα λόγω της παρουσίας φορτισμένων ιόντων.
* ομοιοπολικοί δεσμοί: Η αντιδραστικότητα εξαρτάται από την αντοχή του δεσμού και την παρουσία πολικών ή μη πολικών δεσμών. Τα πολικά ομοιοπολικά μόρια είναι συχνά πιο αντιδραστικά.
* Μεταλλικοί δεσμοί: Μπορεί να αντιδράσει με οξέα και οξυγόνο για να σχηματίσει οξείδια.
* κατάσταση οξείδωσης:
* Ιονικά ομόλογα: Καθορισμένες καταστάσεις οξείδωσης για κάθε ιόν.
* ομοιοπολικοί δεσμοί: Οι καταστάσεις οξείδωσης είναι λιγότερο καθορισμένες, αλλά μπορούν να εκχωρηθούν με βάση τις διαφορές ηλεκτροαρνητικότητας.
Συνοπτικά: Ο τύπος της σύνδεσης μέσα σε μια ουσία καθορίζει τις θεμελιώδεις ιδιότητές της, επηρεάζοντας τα πάντα από τη φυσική του κατάσταση και το σημείο τήξης στην αγωγιμότητα και την αντιδραστικότητα της. Με την κατανόηση της φύσης αυτών των δεσμών, μπορούμε να προβλέψουμε και να εξηγήσουμε τη συμπεριφορά των υλικών και να σχεδιάσουμε νέα υλικά με συγκεκριμένες ιδιότητες.