Πώς διαφέρει το άλας χλωριούχου νατρίου από το νερό σε χημικούς όρους;
Χλωριούχο νάτριο (NaCl):
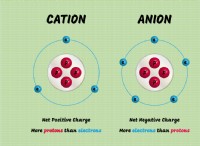
* Δομή: Το χλωριούχο νάτριο είναι μια ιοντική ένωση. Αποτελείται από μια δομή κρυσταλλικού πλέγματος, όπου τα θετικά φορτισμένα ιόντα νατρίου (Na+) και αρνητικά φορτισμένα ιόντα χλωριούχου (Cl-) συγκρατούνται από ισχυρές ηλεκτροστατικές δυνάμεις. Αυτά τα ιόντα είναι διατεταγμένα σε ένα κανονικό, επαναλαμβανόμενο μοτίβο.
* δεσμός: Ο δεσμός μεταξύ νατρίου και χλωριούχου είναι ένας ιοντικός δεσμός, που σχηματίζεται από τη μεταφορά ηλεκτρονίου από νάτριο σε χλώριο.
* Ιδιότητες: Το χλωριούχο νάτριο είναι ένα στερεό σε θερμοκρασία δωματίου, έχει υψηλό σημείο τήξης, είναι διαλυτό στο νερό και διεξάγει ηλεκτρική ενέργεια όταν διαλύεται.
νερό (h₂o):
* Δομή: Το νερό είναι μια ομοιοπολική ένωση. Αποτελείται από δύο άτομα υδρογόνου που συνδέονται ομοιοπολικά με ένα άτομο οξυγόνου. Το μόριο έχει ένα λυγισμένο σχήμα λόγω των μοναχικών ζευγών ηλεκτρονίων στο άτομο οξυγόνου.
* δεσμός: Ο δεσμός μεταξύ υδρογόνου και οξυγόνου είναι ένας ομοιοπολικός δεσμός, που σχηματίζεται από την κατανομή ηλεκτρονίων μεταξύ των ατόμων.
* Ιδιότητες: Το νερό είναι υγρό σε θερμοκρασία δωματίου, έχει σχετικά υψηλό σημείο βρασμού, είναι ένας καλός διαλύτης για πολλές ουσίες και είναι ένας κακός αγωγός ηλεκτρικής ενέργειας.
Βασικές διαφορές:
* δεσμός: Το NaCl έχει ιοντική συγκόλληση, ενώ το H₂O έχει ομοιοπολική συγκόλληση.
* Δομή: Το NaCl σχηματίζει ένα κρυσταλλικό πλέγμα, ενώ το H₂O είναι ένα λυγισμένο μόριο.
* Ιδιότητες: Το NaCl είναι ένα στερεό σε θερμοκρασία δωματίου, ενώ το H₂o είναι υγρό. Το NaCl διεξάγει ηλεκτρική ενέργεια όταν διαλύεται, ενώ ο H₂o είναι ένας κακός αγωγός.
Στην ουσία, το χλωριούχο νάτριο είναι μια ένωση που σχηματίζεται από τη μεταφορά ηλεκτρονίων, με αποτέλεσμα μια άκαμπτη, κρυσταλλική δομή. Το νερό, από την άλλη πλευρά, είναι ένα μόριο που σχηματίζεται από την κοινή χρήση ηλεκτρονίων, οδηγώντας σε υγρή κατάσταση με ισχυρή δέσμευση υδρογόνου μεταξύ μορίων.