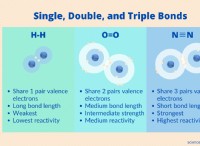
Είναι σημαντικό να διασπαστούν οι ενώσεις;
Γιατί η διάσπαση των ενώσεων είναι σημαντική:
* Παραγωγή ενέργειας: Η διάσπαση των μορίων τροφίμων (όπως οι υδατάνθρακες, τα λίπη και οι πρωτεΐνες) απελευθερώνει ενέργεια που χρησιμοποιούν τα σώματά μας για διάφορες λειτουργίες.
* Χημικές αντιδράσεις: Πολλές χημικές αντιδράσεις απαιτούν τη διάσπαση των υφιστάμενων ενώσεων για τη δημιουργία νέων. Αυτό είναι απαραίτητο σε διαδικασίες όπως η πέψη, η φωτοσύνθεση και η βιομηχανική κατασκευή.
* διάθεση αποβλήτων: Η διάσπαση των αποβλήτων, όπως οι τοξίνες ή τα υπερβολικά θρεπτικά συστατικά, είναι ζωτικής σημασίας για τη διατήρηση της υγείας και την πρόληψη της συσσώρευσης.
* Ανάλυση και έρευνα: Η διάσπαση των σύνθετων ενώσεων στα εργαστήρια επιτρέπει στους επιστήμονες να μελετούν τη δομή, τη σύνθεση και τις ιδιότητές τους. Αυτό είναι ζωτικής σημασίας για την ανάπτυξη νέων φαρμάκων, υλικών και τεχνολογιών.
Όταν η διάσπαση των ενώσεων δεν είναι σημαντική:
* Υλικά διατήρησης: Σε ορισμένες περιπτώσεις, η διάσπαση των ενώσεων μπορεί να είναι ανεπιθύμητη. Για παράδειγμα, θέλουμε να αποτρέψουμε την κατανομή των πλαστικών ή των μετάλλων σε ορισμένες εφαρμογές.
* Διατήρηση σταθερότητας: Ορισμένες ενώσεις είναι σταθερές και δεν χρειάζεται να διασπαστούν. Για παράδειγμα, το νερό είναι μια σταθερή ένωση που δεν αποσυντίθεται εύκολα.
Συνοπτικά:
Η διάσπαση των ενώσεων είναι μια θεμελιώδη διαδικασία σε πολλές πτυχές της ζωής και της επιστήμης. Το αν είναι σημαντικό εξαρτάται από τη συγκεκριμένη κατάσταση και τι σκοπεύουμε να επιτύχουμε. Είναι σημαντικό να εξετάσουμε τα πιθανά οφέλη και τα μειονεκτήματα της κατάρρευσης μιας συγκεκριμένης ένωσης πριν προχωρήσουμε.