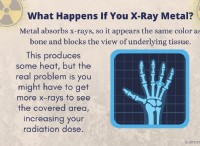
Τι είδους δύναμη υπάρχει μεταξύ των μορίων;
Εδώ είναι οι κύριοι τύποι διαμοριακών δυνάμεων:
1. Δυνάμεις Van der Waals:
* Δυνάμεις διασποράς του Λονδίνου (LDF): Αυτοί είναι ο ασθενέστερος τύπος διαμοριακής δύναμης και εμφανίζονται λόγω προσωρινών, επαγόμενων διπόλων σε μη πολωτικά μόρια. Παρόλο που το μόριο είναι συνολικά ουδέτερο, τα ηλεκτρόνια κινούνται συνεχώς, οδηγώντας σε προσωρινές ανομοιόμορφες κατανομές φορτίου. Αυτά τα προσωρινά δίπολα μπορούν να προκαλέσουν δίπολα σε γειτονικά μόρια, οδηγώντας σε αδύναμη έλξη. Υπάρχουν LDFs μεταξύ όλων των μορίων, αλλά είναι η μόνη διαμοριακή δύναμη που υπάρχει σε μη πολικά μόρια.
* Δυνάμεις διπόλης: Αυτές οι δυνάμεις εμφανίζονται μεταξύ πολικών μορίων (μόρια με μόνιμα διπόλια λόγω της ανομοιόμορφης κατανομής των ηλεκτρονίων). Το θετικό τέλος ενός μορίου προσελκύεται από το αρνητικό άκρο ενός άλλου μορίου. Οι δυνάμεις διπολικής-δίπολης είναι ισχυρότερες από τις LDF.
* δεσμός υδρογόνου: Ένας ειδικός τύπος αλληλεπίδρασης διπολικού-δίπολου που συμβαίνει όταν το υδρογόνο συνδέεται με ένα εξαιρετικά ηλεκτροαρνητικό άτομο όπως το οξυγόνο, το άζωτο ή το φθοριοειδές. Αυτό δημιουργεί ένα πολύ ισχυρό δίπολο, με αποτέλεσμα μια ισχυρή έλξη μεταξύ των μορίων. Η δέσμευση υδρογόνου είναι υπεύθυνη για πολλές από τις μοναδικές ιδιότητες του νερού, όπως το υψηλό σημείο βρασμού του.
2. Δυνάμεις ιόντων: Αυτά συμβαίνουν μεταξύ ιόντων και πολικών μορίων. Το ιόν προσελκύεται από το αντίθετα φορτισμένο τέλος του διπόλου. Αυτές οι δυνάμεις είναι ισχυρότερες από τις δυνάμεις του διπόλου-δίπολου.
Η δύναμη των διαμοριακών δυνάμεων εξαρτάται από διάφορους παράγοντες, όπως:
* πολικότητα: Τα πολικά μόρια έχουν ισχυρότερες διαμοριακές δυνάμεις από τα μη πολικά μόρια.
* Μοριακό μέγεθος και σχήμα: Τα μεγαλύτερα μόρια και τα μόρια με πιο σύνθετα σχήματα έχουν ισχυρότερα LDFs.
* δεσμός υδρογόνου: Η παρουσία δεσμού υδρογόνου οδηγεί σε σημαντικά ισχυρότερες ενδομοριακές δυνάμεις.
Σημασία των διαμοριακών δυνάμεων:
Οι ενδομοριακές δυνάμεις είναι υπεύθυνες για πολλές σημαντικές φυσικές ιδιότητες της ύλης, συμπεριλαμβανομένων:
* Σημείο τήξης και σημείο βρασμού: Οι ισχυρότερες διαμοριακές δυνάμεις έχουν ως αποτέλεσμα υψηλότερα σημεία τήξης και βρασμού.
* ιξώδες: Τα υγρά με ισχυρότερες διαμοριακές δυνάμεις είναι πιο ιξώδη (ροή πιο αργά).
* επιφανειακή τάση: Τα υγρά με ισχυρότερες διαμοριακές δυνάμεις έχουν υψηλότερη επιφανειακή τάση.
* Διαλυτότητα: Παρόμοιες διαμοριακές δυνάμεις μεταξύ διαλυτών και διαλυτών μορίων οδηγούν σε καλύτερη διαλυτότητα.
Η κατανόηση των διαμοριακών δυνάμεων είναι απαραίτητη για την εξήγηση της συμπεριφοράς της ύλης σε διάφορα κράτη και για την πρόβλεψη των ιδιοτήτων διαφορετικών ουσιών.