Τι είναι ένα ιόν; Ορισμός Χημείας
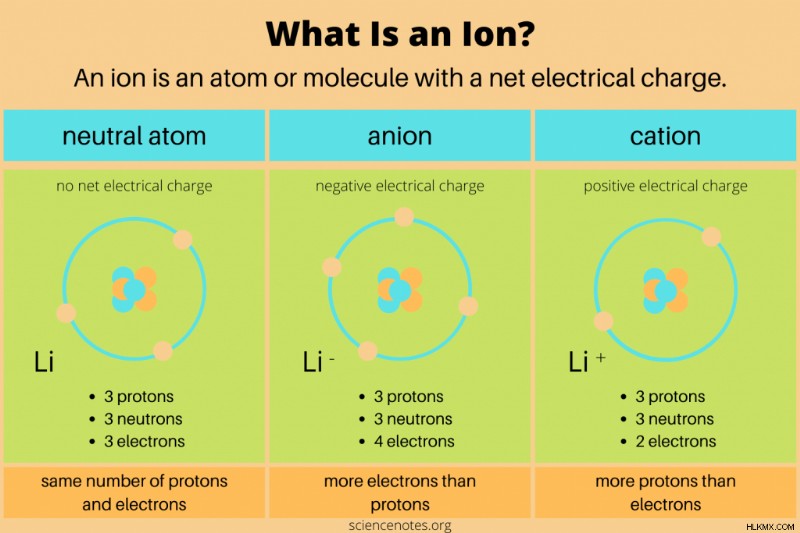
Στη χημεία, ο ορισμός τουιόντος είναι ένα ηλεκτρικά φορτισμένο άτομο ή μόριο. Αυτό σημαίνει ότι το άτομο ή το μόριο έχει άνισο αριθμό πρωτονίων και ηλεκτρονίων. Τα νετρόνια δεν φέρουν καθαρό ηλεκτρικό φορτίο, επομένως δεν επηρεάζουν άμεσα τα ιόντα. Στις χημικές αντιδράσεις, τα ιόντα σχηματίζονται όταν τα άτομα ή τα μόρια αποκτούν ή χάνουν ηλεκτρόνια σθένους. Μόνο οι πυρηνικές αντιδράσεις αλλάζουν τον αριθμό των πρωτονίων σε ένα χημικό είδος.
Ανιόντα και κατιόντα
Οι δύο τύποι ιόντων είναι τα ανιόντα και τα κατιόντα.
- Ένα ανιόν έχει καθαρό αρνητικό ηλεκτρικό φορτίο. Περιέχει περισσότερα ηλεκτρόνια από πρωτόνια. Για παράδειγμα, ένα άτομο χλωρίου με 17 πρωτόνια και 18 ηλεκτρόνια (Cl) είναι ένα ανιόν. Ένα ανιόν μπορεί να είναι μεγαλύτερο από το αρχικό του άτομο εάν αποκτήσει ένα επιπλέον κέλυφος ηλεκτρονίων.
- Ένα κατιόν έχει καθαρό θετικό ηλεκτρικό φορτίο. Περιέχει περισσότερα πρωτόνια από ηλεκτρόνια. Για παράδειγμα, ένα ιόν υδρογόνου με ένα πρωτόνιο και μηδέν ηλεκτρόνια (Η) είναι κατιόν. Ένα κατιόν είναι μικρότερο από το αρχικό του άτομο επειδή το μεγαλύτερο πυρηνικό φορτίο έλκει τα ηλεκτρόνια πιο κοντά.
Ένας τρόπος για να θυμάστε τους ορισμούς κατιόντων και ανιόντων είναι να σκεφτείτε το "t" στο κατιόν σαν ένα σύμβολο "+". Μια άλλη επιλογή είναι να θυμάστε το "ανιόν" σαν να ακούγεται σαν "αρνητικό ιόν".
Επειδή φέρουν αντίθετα ηλεκτρικά φορτία, τα ανιόντα και τα κατιόντα ελκύουν το ένα το άλλο. Τα ανιόντα απωθούν άλλα ανιόντα, ενώ τα κατιόντα απωθούν άλλα κατιόντα. Τόσο το ηλεκτρικό όσο και το μαγνητικό πεδίο επηρεάζουν τα ανιόντα και τα κατιόντα.
Παραδείγματα ιόντων
Η χημική σημείωση υποδεικνύει ιόντα ακολουθώντας ένα σύμβολο στοιχείου ή χημικό τύπο με έναν εκθέτη που δείχνει εάν ένα φορτίο είναι θετικό (+) ή αρνητικό (-) και την ποσότητα του φορτίου. Εάν ένα ηλεκτρικό φορτίο είναι 1, αναφέρετε μόνο το σύμβολο "+" ή "-". Ακολουθούν ορισμένα παραδείγματα ιόντων:
- H+
- Περίπου
- Φε
- Φε
- Κλ
- Π
- NH4
- H3 O
- HCO3
- SO4
Μονατομικά και πολυατομικά ιόντα
Ένα ιόν που περιέχει μόνο ένα άτομο είναι μονατομικό ιόν . Παραδείγματα μονοατομικών ιόντων περιλαμβάνουν Η, Ο και Cl. Ένα ιόν που περιέχει πολλαπλά ιόντα είναι ένα πολυατομικό ιόν ή μοριακό ιόν. Παραδείγματα πολυατομικών ιόντων είναι το αμμώνιο (NH4 ), υδρόνιο (H3 Ο), χλωρικό (CO3). ), και υδροξείδιο (ΟΗ).
Ιστορικό
Η λέξη ιόν προέρχεται από την ελληνική λέξη ion ή ienai , που σημαίνει «να πάω». Ο Άγγλος φυσικός και χημικός Michael Faraday επινόησε τον όρο το 1834 ως τρόπο να περιγράψει τον τρόπο με τον οποίο ένα χημικό είδος ταξιδεύει από το ένα ηλεκτρόδιο στο άλλο σε ένα υδατικό διάλυμα.
Ενώ ο Faraday δεν προσδιόρισε τη φύση των σωματιδίων που κινούνται μεταξύ των ηλεκτροδίων, είδε το μέταλλο να διαλύεται στο ένα ηλεκτρόδιο και να εναποτίθεται στο άλλο ηλεκτρόδιο. Έτσι, κατά κάποιο τρόπο το ηλεκτρικό ρεύμα επηρέασε την κίνηση της ύλης.
Αναφορές
- Cilispie, Charles (επιμ.) (1970). Λεξικό Επιστημονικής Βιογραφίας (1η έκδ.). Νέα Υόρκη:Charles Scribner's Sons. ISBN 978-0-684-10112-5.
- James, Frank A. J. L. (επιμ.) (1991). Η αλληλογραφία του Michael Faraday . Τομ. 2:1832-1840. ISBN 9780863412493.
- Knoll, Glenn F. (1999). Ανίχνευση και μέτρηση ακτινοβολίας (3η έκδ.). Νέα Υόρκη:Wiley. ISBN 978-0-471-07338-3.
- Masterton, William; Hurley, Cecile (2008). Χημεία:Αρχές και Αντιδράσεις . Cengage Learning. ISBN 0-495-12671-3.




