Χημεία για παιδιά – Πώς να διαχωρίσετε το νερό σε υδρογόνο και οξυγόνο χρησιμοποιώντας ηλεκτρόλυση

Σε όλους μας έχουν πει ότι το νερό αποτελείται από υδρογόνο και οξυγόνο. Αλλά πώς πραγματικά ξέρουμε ότι? Μπορεί αυτή η υγρή ουσία που ξεδιψάει και δροσίζει το σώμα μας τις ζεστές μέρες του καλοκαιριού μπορεί πραγματικά να αποτελείται από δύο αέρια ?
Προσπαθήσαμε να διαχωρίσουμε το νερό σε οξυγόνο και υδρογόνο χρησιμοποιώντας ηλεκτρόλυση. Το καταφέραμε μετά από μια σειρά πειραμάτων που μας άφησαν ακόμα περισσότερες ερωτήσεις από ό,τι είχαμε πριν ξεκινήσουμε. Κάτι που δεν είναι απαραίτητα κακό – η περιέργεια είναι μια εξαιρετική κατάσταση μάθησης! (Δείτε τη μυστηριώδη περίπτωση του οξυγόνου που λείπει, παρακάτω.)
Μπορείτε να επωφεληθείτε από τα λάθη μας και να κάνετε ηλεκτρόλυση με τον γρήγορο τρόπο. Δείτε πώς να χωρίσετε το νερό σε υδρογόνο και οξυγόνο χρησιμοποιώντας ηλεκτρόλυση. Στη συνέχεια θα σας πω για το τι κάναμε πρώτα, το οποίο παρήγαγε ένα εντελώς διαφορετικό αέριο.
Πώς να διαχωρίσετε το νερό σε υδρογόνο και οξυγόνο
Τι χρειάζεστε
- γυάλινη ή πλαστική μπανιέρα
- 2 ελαστικές ταινίες
- 2 δοκιμαστικοί σωλήνες (με καπάκια αν είναι δυνατόν)
- διττάνθρακες σόδας (1 κουταλιά της σούπας)
- καλώδια μολυβιού γραφίτη
- νερό
- μπαταρία (χρησιμοποιήσαμε 6V, λίγο σαν αυτή)
- 2 ζεύγη κλιπ κροκόδειλου
- αδιάβροχη ταινία

Τι κάνετε
Δείτε αυτό το βίντεο για λεπτομερείς οδηγίες ρύθμισης – η διάταξη της ελαστικής ταινίας κρατά τους δοκιμαστικούς σωλήνες τέλεια στη θέση τους.
Εάν δεν μπορείτε να παρακολουθήσετε το βίντεο, εδώ είναι η ουσία του: Συνδέστε το ένα άκρο κάθε κλιπ κροκόδειλου σε ένα κομμάτι γραφίτη και το άλλο στην μπαταρία. Στερεώστε τα άκρα γραφίτη στο κάτω μέρος της μπανιέρας με τον γραφίτη να κολλάει προς τα πάνω και τοποθετήστε έναν ανεστραμμένο δοκιμαστικό σωλήνα πάνω από κάθε κομμάτι γραφίτη (που συγκρατείται στη θέση του από τις ελαστικές ταινίες). Διαλύστε το διττάνθρακες της σόδας στο νερό και γεμίστε τη μπανιέρα. Τέλος, αφαιρέστε κάθε δοκιμαστικό σωλήνα, γεμίστε τον με νερό και τοποθετήστε τον προσεκτικά πάνω από τον γραφίτη. Τυχόν αέρια που συλλέγονται κατά την ηλεκτρόλυση θα αντικαταστήσουν το νερό στους σωλήνες, επομένως βεβαιωθείτε ότι δεν υπάρχουν φυσαλίδες αέρα.
Τι συμβαίνει
Γρήγορα αρχίζουν να σχηματίζονται φυσαλίδες αερίου σε κάθε ηλεκτρόδιο. Περισσότερο αέριο συλλέγεται στο αρνητικό ηλεκτρόδιο (κάθοδος) παρά στο θετικό (άνοδος).
Πώς να δοκιμάσετε τα αέρια σας
Όταν έχετε συλλέξει άφθονο αέριο σε κάθε ηλεκτρόδιο, τοποθετήστε προσεκτικά τα καπάκια στους δοκιμαστικούς σωλήνες σας (ενώ είναι ακόμα κάτω από το νερό).
Για δοκιμή για υδρογόνο
Υποθέσαμε ότι το αέριο στην (αρνητική) κάθοδό μας ήταν (θετικά φορτισμένο) υδρογόνο. Το υδρογόνο είναι εκρηκτικό. Δεν θα καταστρέψει το σπίτι σας σε αυτές τις ποσότητες, αλλά θα κάνει έναν δροσερό θόρυβο με την παρουσία ενός αναμμένου θραύσματος ξύλου. Μπορείτε να το ακούσετε στο παρακάτω βίντεο.
Για έλεγχο οξυγόνου
Δοκιμάζουμε για οξυγόνο με λαμπερό νάρθηκα. Εάν υπάρχει αρκετό οξυγόνο, ο νάρθηκας αναζωπυρώνεται. Το αέριο που συλλέξαμε στην άνοδο μας έδωσε μια σύντομη λάμψη που επιβεβαίωσε ότι είναι οξυγόνο, αλλά μετά τον ενθουσιασμό του υδρογόνου που σκάει, ήμασταν λίγο απογοητευμένοι. Αργότερα παράγαμε πολύ περισσότερο οξυγόνο χρησιμοποιώντας μια διαφορετική μέθοδο - δείτε παρακάτω για ένα βίντεο με τον νάρθηκα που ξαναφωτίζει.
Πώς λειτουργεί η ηλεκτρόλυση;
Το νερό είναι ένα ομοιοπολικό μόριο (H20) που συγκρατείται από κοινά ηλεκτρόνια σε ομοιοπολικούς δεσμούς.
Κατά τη διάρκεια της ηλεκτρόλυσης, τα μόρια ανάγεται στην κάθοδο σε αέριο υδρογόνο και οξειδώνονται στην άνοδο σε αέριο οξυγόνο.
Το καθαρό νερό δεν μεταφέρει ηλεκτρισμό, επομένως πρέπει να προσθέσουμε έναν ηλεκτρολύτη, όπως το διττανθρακικό σόδα. (Δεν θα πιστεύετε τον αριθμό των ιστότοπων που σας λένε να χρησιμοποιείτε αλάτι. Το δοκιμάσαμε και συλλέξαμε ένα εντελώς διαφορετικό αέριο. Περισσότερα για αυτό αργότερα.)
Παράγεται διπλάσιο υδρογόνο από το οξυγόνο, αντανακλώντας τη μοριακή σύνθεση του νερού.
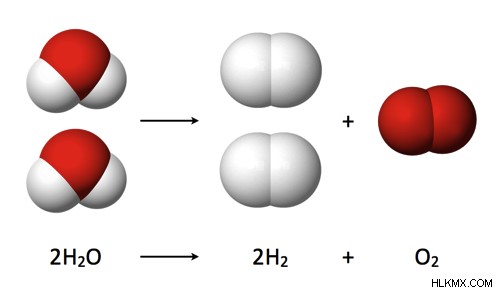
Ακολουθεί μια αρκετά εύκολη εξήγηση της ηλεκτρόλυσης του νερού.
Αν ψάχνετε για μια πιο λεπτομερή εξήγηση, ανατρέξτε στη Wikipedia.
{Ευχαριστώ πολύ, Σάρα, που επισήμανες την προηγούμενη παρεξήγηση μου και που κάνατε αυτήν την ανάρτηση πιο ακριβή!}
Η μυστηριώδης περίπτωση του οξυγόνου που λείπει
(Ή, τι συμβαίνει όταν χρησιμοποιείτε αλάτι ως ηλεκτρολύτη.)
Πριν χωρίσουμε επιτυχώς το νερό σε υδρογόνο και οξυγόνο χρησιμοποιώντας την παραπάνω μέθοδο, προσπαθήσαμε να προσθέσουμε αλάτι για να βοηθήσουμε το νερό μας να μεταφέρει ηλεκτρισμό. Και όχι μόνο μια πρέζα αλάτι. Αποφάσισα ότι αν το αλάτι βοηθούσε λίγο, τότε το πολύ αλάτι θα ήταν ακόμα καλύτερο. (Τελικά, λειτουργεί για κρύσταλλα.)
Ρυθμίζουμε την ηλεκτρόλυση μας χρησιμοποιώντας την ίδια συσκευή όπως παραπάνω αλλά αυτή τη φορά με κορεσμένο διάλυμα αλατιού. Και εκεί καθίσαμε, αναζητώντας ανυπόμονα τις φυσαλίδες μας υδρογόνου και οξυγόνου.
Τι συνέβη? Λοιπόν, πολλά στην κάθοδό μας. Το αέριο άρχισε γρήγορα να γεμίζει τον δοκιμαστικό σωλήνα. Το δοκιμάσαμε και ανακαλύψαμε ότι ήταν υδρογόνο. Και στο θετικό ηλεκτρόδιο; Ούτε μια φούσκα αερίου! Τι είχε συμβεί με το οξυγόνο από τα μόρια του νερού μας;
Έκανα λίγη έρευνα κατά τη διάρκεια της νύχτας.
Φαίνεται ότι κατά την ηλεκτρόλυση του διαλύματος χλωριούχου νατρίου (άλατος), το χλωριούχο νάτριο διασπάται στο θετικό ηλεκτρόδιο για να σχηματίσει αέριο χλώριο και διάλυμα υδροξειδίου του νατρίου. (Κάντε κλικ στον σύνδεσμο για μια πιο λεπτομερή εξήγηση.) Το χλώριο διαλύεται εύκολα στο νερό, επομένως δεν θα συλλέγεται ως αέριο έως ότου το διάλυμα κορεσθεί και δεν μπορεί να απορροφήσει άλλο χλώριο.
Αν λοιπόν το θετικό μας ηλεκτρόδιο ήταν απασχολημένο με την προσέλκυση χλωρίου και το υδρογόνο μάζευε στην κάθοδο… τι είχε συμβεί με το οξυγόνο; Ή στο νάτριο από το χλωριούχο νάτριό μας (NaCl), για αυτό το θέμα; Σύμφωνα με τους χημικούς, το νάτριο και το οξυγόνο συνδυάζονται για να δημιουργήσουν διάλυμα υδροξειδίου του νατρίου. Ζητήθηκε περαιτέρω έρευνα.
Αφήσαμε τη συσκευή μας στημένη - αποσυνδεδεμένη από την μπαταρία - κατά τη διάρκεια της νύχτας. Αποφασίσαμε να το εξετάσουμε για ενδείξεις.
Περαιτέρω έρευνες
Ποιες αλλαγές είχαν συμβεί ως αποτέλεσμα της ηλεκτρόλυσης;
Το αλάτι μας είχε πάρει ένα καφέ χρώμα. Αυτό ήταν διαλυμένο χλώριο; Σπασμένος γραφίτης; Διαβρωμένο κλιπ κροκόδειλου (που είχε προσαρτηθεί στην άνοδο);

Φιλτράρισμα της λύσης .
Μερικά από τα θετικά μας ηλεκτρόδια (άνοδος) χάλασαν, αφήνοντας μαύρα κομμάτια στο διάλυμα. Χρησιμοποιούμε γραφίτη στην ηλεκτρόλυση επειδή είναι αδρανές (μη αντιδραστικό) μέταλλο, αλλά μήπως οι μεγάλες ποσότητες χλωρίου που παράγαμε είχαν προκαλέσει την αντίδραση; Φιλτράραμε το καφέ διάλυμα για να δούμε αν παρέμειναν αδιάλυτα κομμάτια. Δεν το έκαναν. Όμως παρατηρήσαμε κάποιες λευκές κηλίδες στο διηθητικό χαρτί – το χλώριο που παράγεται στο θετικό μας ηλεκτρόδιο πρέπει να έχει λευκάνει το χαρτί!


Δοκιμή του pH του διαλύματος
Υποθέσαμε ότι το διάλυμα θα ήταν ελαφρώς αλκαλικό λόγω του υδροξειδίου του νατρίου. Όταν όμως το δοκιμάσαμε, διαπιστώσαμε το αντίθετο. Ήταν ελαφρώς όξινο - όπως το χλώριο. Μαντέψαμε ότι αυτό σήμαινε ότι το διάλυμα πρέπει να περιέχει περισσότερο χλώριο από υδροξείδιο.
Περισσότερη διασκέδαση με το οξυγόνο
Ξεφεύγω λίγο από το θέμα εδώ, αλλά υποσχέθηκα να πω πώς δημιουργήσαμε αρκετό οξυγόνο για να το δοκιμάσουμε με επιτυχία. Πήραμε την ιδέα πηγαίνοντας στο The Magic of Oxygen παράσταση στο Βασιλικό Ίδρυμα. Θα ήθελα πολύ να μοιραστώ μαζί σας μια από τις διαδηλώσεις που είδαμε εκεί.
Οι παρουσιαστές με ρώτησαν αν μπορούσαν να δανειστούν ένα χαρτονόμισμα των 10 λιρών από εμένα – και μετά έβαλαν φωτιά! Ακολουθεί ένα βίντεο με τα φλεγόμενα χρήματά μου.
Λίγο καιρό αργότερα οι επιστήμονες μου επέστρεψαν το χαρτονόμισμα των 10 λιρών – εντελώς άθικτο. Το κόλπο ήταν ότι οι επιστήμονες πρώτοι μούσκεψαν τα χρήματα σε αλκοόλ. Το αλκοόλ που καίγεται στο οξυγόνο παράγει θερμότητα, φως, διοξείδιο του άνθρακα και νερό. Η θερμοκρασία στην οποία καίγεται το αλκοόλ είναι πολύ χαμηλή για να εξατμιστεί το νερό, επομένως το νερό προστατεύει τη νότα από το κάψιμο.

Η Μαγική του Οξυγόνου Οι επιστήμονες έδειξαν επίσης πώς να φτιάχνουν «οδοντόκρεμα ελέφαντα» διασπώντας το υπεροξείδιο του υδρογόνου. Θυμηθήκαμε πώς κάποτε φτιάξαμε τη δική μας οδοντόκρεμα ελέφαντα. Όταν φτάσαμε στο σπίτι, αποφασίσαμε να φτιάξουμε ξανά οδοντόκρεμα ελέφαντα και να χρησιμοποιήσουμε έναν λαμπερό νάρθηκα για να ελέγξουμε για αέριο οξυγόνο.

Όταν τοποθετείτε έναν λαμπερό νάρθηκα σε οξυγόνο, ο νάρθηκας ανάβει ξανά.
Γιατί αυτός είναι ο αγαπημένος μου τρόπος να κάνω επιστήμη στο σπίτι
Όπως μπορείτε να πείτε, αυτό δεν ήταν το είδος της επίδειξης επιστήμης στο σπίτι όπου η μαμά ξέρει ακριβώς τι πρόκειται να συμβεί και γιατί. Σπούδασα χημεία μέχρι τα δεκαέξι μου – πριν από σχεδόν τριάντα χρόνια! Δεν ήξερα τις απαντήσεις σε πολλές από τις ερωτήσεις που δημιουργήθηκαν από αυτά τα πειράματα.
Αλλά το να μην ήξερα τι θα συνέβαινε με έκανε να περιεργάζομαι και με ενέπνευσα να μάθω περισσότερα, και τα παιδιά ήταν σίγουρα παγιδευμένα στον ενθουσιασμό μου. Και χαίρομαι που κάναμε το «λάθος» να χρησιμοποιήσουμε πρώτα το αλάτι ως ηλεκτρολύτη, γιατί αν δεν το είχαμε θα είχαμε χάσει μια πολύ ενδιαφέρουσα επιστήμη!
Έχετε κάνει κάποια διασκεδαστική επιστήμη πρόσφατα;
Έχετε ερευνήσει ποτέ μια περίπτωση έλλειψης οξυγόνου;
***
Σύνδεομαι με ευγνωμοσύνη εδώ:
Εβδομαδιαία σύνοψη – Περίεργοι μη κοινωνικοποιημένοι μαθητές στο σπίτι
Κολάζ Παρασκευής – Οικτικοί μαθητές
The Home Ed Link Up #16 – Περιπέτειες στην εκπαίδευση στο σπίτι
Science Sunday – Adventures in Mommydom
Finishing Strong – Starts at Eight
The Hip Homeschool Hop – Hip Homeschool Moms
![]()