Είναι το H2O (Νερό) πολικό ή μη πολικό;

Νερό (H2 O) είναι μια άχρωμη, άοσμη και άγευστη ένωση που είναι ζωτικής σημασίας για κάθε γνωστή ζωντανή διαδικασία. Το νερό είναι ένα πολικό μόριο, που σημαίνει ότι έχει μια καθαρή διπολική ροπή στη δομή του λόγω της άνισης χωρικής κατανομής των ηλεκτρονίων που το αποτελούν.
Η πολικότητα του νερού εξηγεί πολλές από τις μοναδικές φυσικές ιδιότητές του, όπως το υψηλό σημείο βρασμού/ειδική θερμοχωρητικότητα, την επιφανειακή τάση και τις ικανότητές του σε διαλύτες.
Ηλεκτραρνητικότητα και πολικότητα του νερού
Η πολικότητα μιας χημικής ένωσης οφείλεται στην πολικότητα των επιμέρους χημικών δεσμών που την αποτελούν. Κάθε χημικό στοιχείο έχει μια ηλεκτραρνητικότητα. Η ηλεκτραρνητικότητα ενός στοιχείου μπορεί να θεωρηθεί ως μέτρο του πόσο «πεινασμένο» είναι ένα άτομο αυτού του στοιχείου για ηλεκτρόνια. Τα άτομα με λίγα ηλεκτρόνια στο εξωτερικό τους περίβλημα τείνουν να είναι λιγότερο ηλεκτραρνητικά και τα άτομα με πολλά ηλεκτρόνια στο εξωτερικό τους περίβλημα τείνουν να είναι πολύ ηλεκτραρνητικά (εκτός από τα ευγενή αέρια, τα οποία έχουν πλήρες εξωτερικό περίβλημα ηλεκτρονίων και επομένως είναι πολύ αδρανή).
Το αν δύο στοιχεία θα σχηματίσουν έναν πολικό δεσμό ή όχι εξαρτάται από τη σχετική διαφορά μεταξύ των ηλεκτραρνητικοτήτων αυτών των στοιχείων. Εάν οι ηλεκτραρνητικότητες είναι πανομοιότυπες, ο δεσμός θα είναι εντελώς μη πολικός. Ένας εντελώς πολικός δεσμός περιλαμβάνει το πιο ηλεκτραρνητικό στοιχείο που παίρνει ηλεκτρόνια από το λιγότερο ηλεκτραρνητικό στοιχείο και ονομάζεται πιο σωστά ιονικός δεσμός. Έτσι, ο όρος "πολικός" προορίζεται κυρίως για ομοιοπολικούς δεσμούς που έχουν μια σχετική διαφορά ηλεκτραρνητικοτήτων που κυμαίνεται μεταξύ 0,05-2,0.
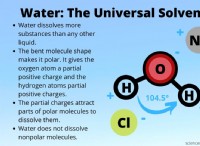
Στους πολικούς δεσμούς, το πιο ηλεκτραρνητικό στοιχείο θα ασκήσει άνιση έλξη στα ηλεκτρόνια του μορίου. Αυτό αναγκάζει τα ηλεκτρόνια να τείνουν προς τη μία πλευρά του μορίου. Η καθαρή κίνηση των ηλεκτρονίων δημιουργεί μια διπολική ροπή στο μόριο, με θετικό άκρο και αρνητικό άκρο. Έτσι, για παράδειγμα, το νερό είναι ένα μόριο που αποτελείται από δύο άτομα υδρογόνου και ένα άτομο οξυγόνου. Το οξυγόνο είναι πιο ηλεκτραρνητικό από το υδρογόνο, επομένως όταν τα άτομα συνδέονται, το οξυγόνο ασκεί ισχυρότερη έλξη στα ηλεκτρόνια του μορίου. Εξαιτίας αυτής της έλξης, τα ηλεκτρόνια υφίστανται μια καθαρή κίνηση προς το άκρο του οξυγόνου του ατόμου. Η κίνηση δημιουργεί μια διπολική ροπή με δύο θετικά φορτισμένους κόμβους στα άκρα του υδρογόνου και έναν αρνητικά φορτισμένο κόμβο στο άκρο του οξυγόνου. Η ανομοιόμορφη έλξη των ηλεκτρονίων εξηγεί επίσης το γεωμετρικό σχήμα ενός μορίου νερού. ένα λυγισμένο τριατομικό μόριο με γωνία δεσμού 104,5°.
Πολικότητα και οι φυσικές ιδιότητες του νερού
Η πολικότητα του νερού είναι υπεύθυνη για πολλές από τις μοναδικές φυσικές ιδιότητες του νερού. Πρώτον, η πολικότητα του νερού εξηγεί τις ιδιότητες του διαλύτη. Ένα δείγμα υγρού νερού είναι ικανό να διαλύσει έναν αριθμό ιοντικών ενώσεων όπως άλατα, πολικές οργανικές ενώσεις όπως αιθανόλη (αλκοόλη) και οξέα. Τα πολικά μόρια του νερού ασκούν έλξη σε οποιαδήποτε ιόντα ή άλλα πολικά μόρια, απομακρύνοντάς τα από τη μεγαλύτερη δομή τους και διαλύοντάς τα. Επειδή μπορεί εύκολα να διαλύσει ιοντικές ενώσεις, το νερό μπορεί να χρησιμεύσει ως καλός αγωγός του ηλεκτρισμού. Παρά την κοινή γνώση, το καθαρό νερό από μόνο του είναι κακός αγωγός του ηλεκτρισμού. Ωστόσο, όταν το νερό διαλύει μια μικρή ποσότητα μιας ιοντικής ένωσης (όπως το επιτραπέζιο αλάτι), γίνεται ηλεκτρικός αγωγός. Σχεδόν κάθε ζωντανός οργανισμός βασίζεται στις διαλυτικές ικανότητες του νερού για να επιβιώσει.
Η πολικότητα του νερού του επιτρέπει επίσης να εμπλέκεται σε ένα ειδικό είδος διαμοριακού δεσμού που ονομάζεται δεσμός υδρογόνου . Ο δεσμός υδρογόνου συμβαίνει όταν το υδρογόνο συνδέεται με ένα πιο ηλεκτραρνητικό στοιχείο (π.χ. οξυγόνο, άζωτο, φθόριο) και είναι παρουσία ενός άλλου πολικού μορίου ή ενός μοναχικού ζεύγους ηλεκτρονίων. Το θετικά φορτισμένο άκρο υδρογόνου ενός μορίου νερού έλκει τα αρνητικά φορτισμένα άκρα οξυγόνου, δημιουργώντας έναν μερικό ηλεκτροστατικό δεσμό μεταξύ διαφορετικών μορίων νερού. Ένα μόνο μόριο νερού μπορεί να δεσμεύσει έως και 4 δεσμούς υδρογόνου με γειτονικά μόρια νερού.
Επειδή η ηλεκτροστατική έλξη είναι ανάλογη με το τετράγωνο της απόστασης μεταξύ δύο φορτισμένων σωμάτων, όσο πιο κοντά μπορεί να φτάσει ένα άτομο υδρογόνου σε ένα γειτονικό μόριο τόσο ισχυρότερος θα είναι ο δεσμός. Δεδομένου ότι τα άτομα υδρογόνου είναι τόσο μικρά, μπορούν να πλησιάσουν εξαιρετικά τα γειτονικά άτομα οξυγόνου και να σχηματίσουν σχετικά ισχυρούς ηλεκτροστατικούς δεσμούς.
Η ισχύς των δεσμών υδρογόνου μεταξύ των μορίων του νερού εξηγεί το υψηλό σημείο βρασμού του νερού (100°C) σε σύγκριση με άλλες ενώσεις με παρόμοια χημική δομή (υδρόθειο). Οι δεσμοί υδρογόνου απαιτούν μεγάλη ποσότητα κινητικής ενέργειας για να σπάσουν, γεγονός που εξηγεί επίσης τη σχετικά υψηλή ειδική θερμική ικανότητα του νερού (4,2 J/Kg). Οι δεσμοί υδρογόνου είναι επίσης υπεύθυνοι για την υψηλή επιφανειακή τάση του νερού. Τα μόρια στην επιφάνεια ενός δείγματος νερού θα σχηματίσουν ισχυρότερους δεσμούς με τα γειτονικά τους μόρια νερού παρά με τα μόρια στον αέρα ακριβώς από πάνω. Η συνοχή των μορίων του νερού δημιουργεί ένα «φίλμ» στην επιφάνεια που μπορεί να υποστηρίξει κάποιο βάρος. Μια χούφτα ζώα, όπως οι θαλάσσιοι οδηγοί και μερικά γκέκο, έχουν εξελιχθεί για να επωφεληθούν από αυτήν την υψηλή επιφανειακή τάση και μπορούν πραγματικά να περπατήσουν πάνω στο νερό. Αυτή η μοριακή συνοχή εξηγεί επίσης γιατί το νερό έχει την τάση να πηγαίνει ενάντια στη βαρύτητα και να σκαρφαλώνει στα τοιχώματα των στενών σωλήνων. Τα αγγειακά φυτά εκμεταλλεύονται αυτή την τριχοειδική δράση για να αντλούν νερό από τις ρίζες στο σώμα του φυτού.
Η πολικότητα και οι δεσμοί υδρογόνου είναι υπεύθυνοι για τη μοναδική πολυφασική φύση του νερού. Το νερό είναι η μόνη ένωση που είναι γνωστό ότι υπάρχει συνήθως και στις τρεις φάσεις της ύλης (στερεό, υγρό, αέριο) υπό φυσικές συνθήκες. Επειδή το νερό είναι πολικό και εμπλέκεται σε δεσμούς υδρογόνου, έχει ένα σχετικά σταθερό φυσικό προφίλ σε ένα ευρύ φάσμα συνθηκών θερμοκρασίας και πίεσης. Επιπλέον, η παρουσία δεσμών υδρογόνου εξηγεί γιατί το νερό διαστέλλεται όταν παγώνει. Όλες οι ενώσεις γίνονται πιο πυκνές όταν ψύχονται, αλλά μόλις το νερό κρυώσει στους 4°C περίπου, αρχίζει να διαστέλλεται. Η αργή κίνηση των μορίων σε ένα ψυχρό δείγμα νερού διευκολύνει το σχηματισμό δεσμών υδρογόνου και τη διάταξη των μορίων σε μια κρυσταλλική δομή. Το αποτέλεσμα είναι ότι ο όγκος ενός δείγματος παγωμένου νερού αυξάνεται κατά περίπου 9%, γι' αυτό το κουτάκι αναψυκτικού σας θα εκραγεί στην κατάψυξη
Συνολικά, το νερό είναι μια πολική ένωση που σχηματίζεται από δύο άτομα υδρογόνου και ένα άτομο οξυγόνου. Το πιο ηλεκτραρνητικό άτομο οξυγόνου ασκεί μια άνιση έλξη στα συστατικά ηλεκτρόνια του μορίου, προκαλώντας μια καθαρή διπολική ροπή σε όλο το μόριο. Η πολικότητα του νερού εξηγεί πολλές από τις μοναδικές ιδιότητες του νερού και εξηγεί γιατί είναι απαραίτητο συστατικό για τη ζωή.