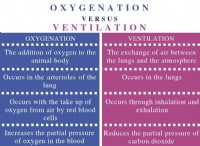
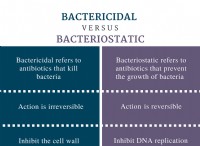
Ποια είναι η μισή κυτταρική αντίδραση του συνηθισμένου ξηρού κυττάρου;
άνοδο (αρνητικό ηλεκτρόδιο):
* Οξείδωση: Zn (s) → Zn²⁺ (aq) + 2e⁻
κάθοδος (θετικό ηλεκτρόδιο):
* Μείωση: 2mno₂ (s) + 2H⁺ (aq) + 2e⁻ → mn₂o₃ (s) + h₂o (l)
Συνολική αντίδραση:
(S) + 2mno₂ (s) + 2H⁺ (aq) → Zn2⁺ (aq) + mn₂o₃ (s) + h₂o (l)
Επεξήγηση:
* Άνοψη (ψευδάργυρος): Το ηλεκτρόδιο ψευδαργύρου οξειδώνεται, που σημαίνει ότι χάνει ηλεκτρόνια και σχηματίζει ιόντα ψευδαργύρου (Zn²⁺). Αυτά τα ηλεκτρόνια ρέουν μέσω του εξωτερικού κυκλώματος στην κάθοδο.
* Καθαίδα (διοξείδιο του μαγγανίου): Το διοξείδιο του μαγγανίου (MNO₂) μειώνεται, πράγμα που σημαίνει ότι κερδίζει ηλεκτρόνια. Τα ηλεκτρόνια αντιδρούν με ιόντα MnO₂, νερό και υδρογόνο (H⁺) για να σχηματίσουν οξείδιο του μαγγανίου (III) (Mn₂o₃) και νερό. Τα ιόντα υδρογόνου προέρχονται από τον ηλεκτρολύτη χλωριούχου αμμωνίου (NH₄Cl).
Σημείωση:
* Το ξηρό κύτταρο δεν είναι πραγματικά "ξηρό" καθώς περιέχει έναν υγρό ηλεκτρολύτη πάστα.
* Ο ηλεκτρολύτης είναι ένα μίγμα χλωριούχου αμμωνίου (NH₄Cl) και χλωριούχο ψευδάργυρο (ZNCL₂).
* Η αντίδραση δεν είναι πλήρως αναστρέψιμη, καθιστώντας το ξηρό κύτταρο ένα πρωτογενές κύτταρο (μη επαναληπτικό).