Αυτοκατάλυση
Ο Γερμανός χημικός Wilhelm Ostwald εισήγαγε την έννοια της αυτοκατάλυσης για να χαρακτηρίσει το ρυθμό μιας αντίδρασης ως συνάρτηση του χρόνου. Για να κατανοήσουμε την αυτοκατάλυση, πρέπει πρώτα να κατανοήσουμε την κατάλυση. Η κατάλυση είναι μια χημική διαδικασία κατά την οποία ο ρυθμός αντίδρασης επηρεάζεται (συνήθως μια επιτάχυνση) με την προσθήκη μιας ουσίας γνωστής ως καταλύτης.
Σύμφωνα με τον πρωταρχικό επιστημονικό ορισμό, η αυτοκατάλυση αναφέρεται στην κατάλυση από ένα ή περισσότερα προϊόντα μιας χημικής αντίδρασης. Η αντίδραση που περιλαμβάνει αυτοκατάλυση οδηγεί σε ένα προϊόν που δρα ως αυτοκαταλύτης. Η αυτόματη κατάλυση είναι επίσης γνωστή ως αυτόματη ενεργοποίηση και στην αυτόματη κατάλυση, ένα από τα προϊόντα λειτουργεί ως καταλύτης.
Διαφορά μεταξύ Autocatalysis και Catalysis
Τώρα, ας καταλάβουμε τη διαφορά μεταξύ ενός καταλύτη και ενός αυτοκαταλύτη. Ένας καταλύτης είναι γενικά μια ξένη ουσία που προστίθεται σε μια αντίδραση για να αλλάξει ή να αλλάξει τον ρυθμό αντίδρασης. Χρησιμοποιείται για την επιτάχυνση της αντίδρασης για γρήγορη ολοκλήρωση, ενώ σε μια αυτοκαταλυτική αντίδραση, ο καταλύτης είναι προϊόν της χημικής αντίδρασης και ονομάζεται αυτοκαταλύτης και επομένως είναι αυτοκαταλύτης. Αυτός είναι ο λόγος που μια αυτοκαταλυτική αντίδραση θεωρείται αυτοκαταλυόμενη αντίδραση. Επομένως, δεν υπάρχει ανάγκη προσθήκης ξένου καταλύτη σε μια αυτοκαταλυτική αντίδραση. Για να διευκρινίσουμε περαιτέρω την έννοια του αυτοκαταλύτη, ας εξετάσουμε αυτό το παράδειγμα:
Σκεφτείτε την ακόλουθη χημική αντίδραση:
A+B → C+D
Εδώ, έχουμε τα αντιδρώντα Α και Β που δημιουργούν τα προϊόντα C και D.
Ας θεωρήσουμε αυτή την αντίδραση ως αυτοκαταλυτική αντίδραση. Σύμφωνα με την ιδέα, σε αυτή τη χημική αντίδραση, τα αντιδρώντα Α και Β θα σχηματίσουν προϊόντα στα οποία ένα από αυτά θα ενεργεί ως αυτοκαταλύτης για την απόκριση, ας πούμε το C θα ενεργεί ως αυτοκαταλύτης εδώ, κάτι που θα συμβάλει στην αύξηση του ρυθμού της χημικής αντίδρασης, και έτσι βοηθούν στη γρήγορη ολοκλήρωση της χημικής αντίδρασης. Όλο αυτό το φαινόμενο είναι γνωστό ως autocatalysis.
Αυτοκαταλυτικές αντιδράσεις σε βάθος
Η απλούστερη αυτοκαταλυτική αντίδραση μπορεί να γραφτεί ως:
A + B ⇌ 2B
Με τις εξισώσεις ρυθμού (για μια στοιχειώδη αντίδραση)
d[A]/dt=-k+[A][B] + k-[B]2
d[B]/dt=+k+[A][B]-K-[B]2
Σε αυτήν την αντίδραση, το μόριο του είδους Α αντιδρά με τα μόρια του είδους Β. Μετά την αντίδραση, έχουμε
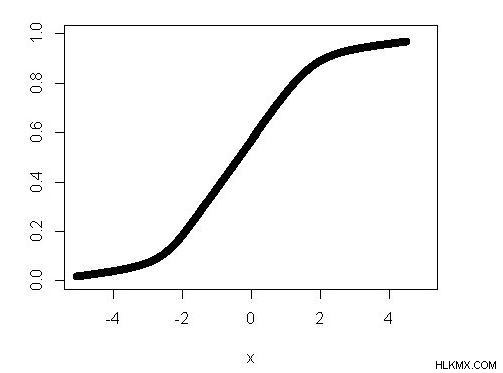
Το γράφημα που δίνεται εδώ είναι για αυτές τις παραπάνω εξισώσεις. είναι μια σιγμοειδής καμπύλη (ακριβώς μια λογιστική συνάρτηση). Αυτό δείχνει ότι οι αντιδράσεις προχωρούν αργά στην αρχή της απόκρισης. Ακόμα, με την πάροδο του χρόνου λόγω της παρουσίας ενός καταλύτη, ο ρυθμός της αντίδρασης αυξάνεται προοδευτικά καθώς προχωρά η αντίδραση, και στη συνέχεια πάλι, η συγκέντρωση των αντιδρώντων μειώνεται. Εάν οποιαδήποτε αντίδραση ακολουθεί τη σιγμοειδή καμπύλη, η αντίδραση μπορεί να είναι μια αυτοκαταλυτική αντίδραση.
Παραδείγματα αυτόματης κατάλυσης
Η αποσύνθεση της αρσίνης καταλύεται από το αρσενικό, το οποίο παράγεται στην αντίδραση.
2AsH3 → 2As + 3H2
Το βασικό χαρακτηριστικό αυτών των χημικών αντιδράσεων είναι ότι είναι μη γραμμικές. Το γράφημα της καμπύλης συγκέντρωσης-χρόνου του σχηματισμού του αυτοκαταλύτη έχει μια σιγμοειδή μορφή που οδηγεί στη φάση ανάπτυξης αυτο-επιτάχυνσης της αυτοκαταλυτικής αντίδρασης.
Αρχικά, ο ρυθμός αντίδρασης είναι πολύ αργός, αλλά με την πάροδο του χρόνου, ο ρυθμός αντίδρασης αυξάνεται. Η αυτοκατάλυση είναι μία από τις οδούς για τη χειρόμορφη συμμετρία και είναι επίσης υπεύθυνη για το σχηματισμό προτύπων στις χημικές αντιδράσεις.
Τι είναι ένας αυτοκαταλυτικός αντιδραστήρας;
Ο αντιδραστήρας είναι μια συσκευή στην οποία μπορούμε να προχωρήσουμε σε οποιαδήποτε χημική, βιολογική και φυσική αντίδραση σκόπιμα, σκόπιμα και με καλά ελεγχόμενο τρόπο. Μερικά παραδείγματα μεγάλων αυτοκαταλυτικών αντιδραστήρων περιλαμβάνουν CSTR, CSTR σε σειρά, αντιδραστήρες ροής βύσματος και αντιδραστήρες ανακύκλωσης. Η επιλογή ενός ιδανικού αντιδραστήρα για να προχωρήσει η χημική αντίδραση σε μια αυτοκαταλυτική χημική αντίδραση είναι ζωτικής σημασίας.
Συμπέρασμα
Αυτό το άρθρο εξετάζει την αυτόματη κατάλυση και τα βασικά χαρακτηριστικά της. Μπορούμε να συμπεράνουμε ότι η αυτοκατάλυση είναι μια διαδικασία κατά την οποία ένα από τα προϊόντα μιας αντίδρασης δρα ως αυτοκαταλύτης που βοηθά στην επιτάχυνση και επομένως στην ταχεία ολοκλήρωση της αντίδρασης. Η αντίδραση στην οποία λαμβάνει μέρος η αυτοκατάλυση είναι γνωστή ως αυτοκαταλυτική αντίδραση. Ο αυτοκαταλύτης σε μια αυτοκαταλυτική αντίδραση ονομάζεται Αυτοκαταλύτης. Το γράφημα συγκέντρωσης-χρόνου της αυτοκατάλυσης είναι γενικά σε σιγμοειδή μορφή. Μια αυτοκαταλυτική αντίδραση συνήθως εξελίσσεται αργά αρχικά, αλλά ο ρυθμός αντίδρασης αυξάνεται με το χρόνο λόγω μιας μικρής ποσότητας καταλύτη.




