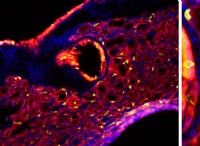
Ποια χαρακτηριστικά μπορούν να διαφέρουν στα ένζυμα;
1. Δομή:
* Πρωτογενής δομή: Η αλληλουχία αμινοξέων της πολυπεπτιδικής αλυσίδας. Ακόμη και μια μεμονωμένη αλλαγή αμινοξέων μπορεί να μεταβάλει σημαντικά τη δραστηριότητα ενός ενζύμου.
* Δευτερεύουσα δομή: Τοπικά μοτίβα πτυσσόμενου όπως άλφα-ελικοειδή και βήτα-φύλλα. Αυτές οι δομές είναι ζωτικής σημασίας για το συνολικό σχήμα και τη λειτουργία του ενζύμου.
* Τριτοβάθμια δομή: Το τρισδιάστατο σχήμα ολόκληρης της αλυσίδας πολυπεπτιδίου. Αυτή η δομή καθορίζει την ενεργό θέση και την αλληλεπίδραση του ενζύμου με τα υποστρώματα.
* Τεχνική δομή: Η διάταξη πολλαπλών πολυπεπτιδίων αλυσίδων (υπομονάδων) σε ένα σύμπλεγμα. Ορισμένα ένζυμα απαιτούν πολλαπλές υπομονάδες για σωστή λειτουργία.
2. Ειδικότητα:
* Ειδικότητα υποστρώματος: Η ικανότητα ενός ενζύμου να δεσμεύει και να καταλύει ένα συγκεκριμένο υπόστρωμα ή μια μικρή ομάδα υποστρωμάτων. Ορισμένα ένζυμα είναι ιδιαίτερα συγκεκριμένα, ενώ άλλα μπορούν να δρουν σε ένα ευρύτερο φάσμα μορίων.
* Στερεοφικία: Η ικανότητα ενός ενζύμου να διακρίνει μεταξύ διαφορετικών στερεοϊσομερών ενός υποστρώματος. Αυτό είναι σημαντικό για τις αντιδράσεις που περιλαμβάνουν χειρόμορφα μόρια.
3. Δραστηριότητα:
* Βέλτιστο ph: Κάθε ένζυμο έχει ένα συγκεκριμένο ρΗ στο οποίο παρουσιάζει την υψηλότερη δραστικότητα του. Οι μεταβολές στο ρΗ μπορούν να μεταβάλλουν το σχήμα του ενζύμου και να επηρεάσουν την ικανότητά του να δεσμεύεται με το υπόστρωμα.
* Βέλτιστη θερμοκρασία: Τα ένζυμα έχουν τη βέλτιστη περιοχή θερμοκρασίας για τη δραστηριότητα. Οι υψηλές θερμοκρασίες μπορούν να μειώσουν το ένζυμο, ενώ οι χαμηλές θερμοκρασίες επιβραδύνουν τον ρυθμό αντίδρασης.
* km τιμή: Ένα μέτρο της συγγένειας του ενζύμου για το υπόστρωμα του. Ένα χαμηλότερο km υποδεικνύει υψηλότερη συγγένεια.
* vmax: Η μέγιστη ταχύτητα μιας καταλυόμενης με ένζυμο αντίδραση. Αυτή η τιμή αντιπροσωπεύει το σημείο όπου το ένζυμο είναι πλήρως κορεσμένο με υπόστρωμα.
* Αριθμός κύκλου εργασιών: Ο αριθμός των μορίων του υποστρώματος που μετατρέπονται σε προϊόν ανά μονάδα χρόνου με ένα μόνο ενζυμικό μόριο. Αυτό αντικατοπτρίζει την αποτελεσματικότητα του ενζύμου.
4. Κανονισμός:
* αλλοστερική ρύθμιση: Αναστολή ή ενεργοποίηση της ενζυμικής δραστικότητας με δέσμευση μορίων σε μια θέση διαφορετική από την ενεργό θέση.
* Αναστολή ανάδρασης: Ρύθμιση όπου το προϊόν μιας αντίδρασης αναστέλλει το ένζυμο που καταλύει την αντίδραση.
* ομοιοπολική τροποποίηση: Μεταβολές της ενζυμικής δραστικότητας με προσθήκη ή απομάκρυνση χημικών ομάδων όπως η φωσφορυλίωση ή η ακετυλίωση.
5. Τοποθεσία:
* Κυτταρικός εντοπισμός: Τα ένζυμα μπορούν να εντοπιστούν σε διαφορετικά κυτταρικά διαμερίσματα, όπως το κυτταρόπλασμα, τα μιτοχόνδρια, ο πυρήνας και η συσκευή Golgi.
* Ειδικότητα ιστών: Ορισμένα ένζυμα βρίσκονται σε συγκεκριμένους ιστούς ή όργανα, αντανακλώντας τις εξειδικευμένες λειτουργίες τους.
Αυτά τα χαρακτηριστικά απεικονίζουν την ποικιλομορφία και την πολυπλοκότητα των ενζύμων, επιτρέποντάς τους να καταλύουν ένα ευρύ φάσμα βιοχημικών αντιδράσεων που είναι απαραίτητες για τη ζωή. Η κατανόηση αυτών των διαφορών είναι ζωτικής σημασίας για την κατανόηση των περίπλοκων μηχανισμών των κυτταρικών διεργασιών και για την ανάπτυξη νέων φαρμάκων και θεραπειών.