Πώς λειτουργούν οι αγώνες ασφαλείας;
Όταν χτυπάτε το ραβδί στην επιφάνεια που χτυπά, η τριβή που δημιουργείται προκαλεί τη μετατροπή μέρους του κόκκινου φωσφόρου σε λευκό φώσφορο, ο οποίος είναι
Πραγματικά δεν μπορώ να φανταστώ πώς θα ένιωθαν οι πρωτόγονοι άντρες, που πρώτοι έβγαλαν φωτιά τρίβοντας πέτρες μεταξύ τους, αν τους έδειχναν μερικά σπίρτα. Μάλλον δεν θα ήξεραν καν τι κοιτούσαν! Μερικά μικροσκοπικά κλαδάκια με χρωματιστές μύτες!?
Όπως και να έχει, πρέπει να δώσουμε στους αρχαίους προγόνους μας κάποια εύσημα που μας μύησαν στην ιδέα του πώς το τρίψιμο των πραγμάτων μεταξύ τους –ή με τεχνικούς όρους, η τριβή– θα μπορούσε να ζεστάνει τα πράγματα και να καεί… που είναι η βασική αρχή πίσω από το πώς λειτουργούν τα σπιρτόξυλα .
Σύνθεση αντιστοιχιών
Τα σπίρτα, όπως σίγουρα έχετε παρατηρήσει, αποτελούνται από ένα κεφάλι και ένα ξύλινο ραβδί.
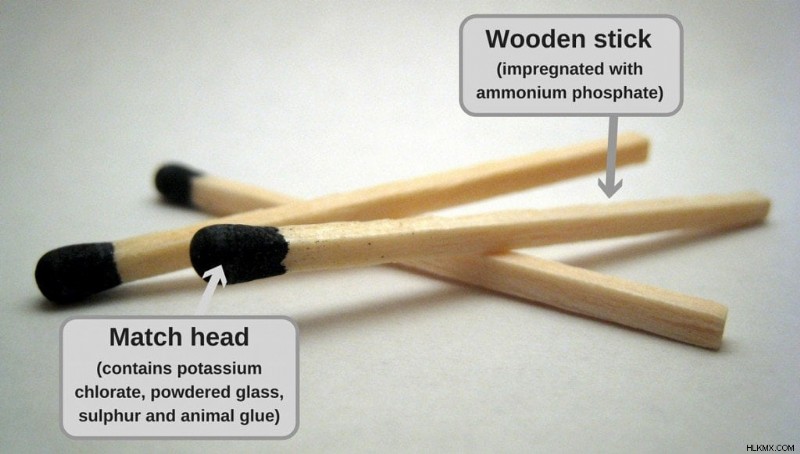
Μέρη ενός αγώνα ασφαλείας (Πηγή εικόνας:commons.wikimedia.org)
Το κεφάλι συνήθως περιέχει χλωρικό κάλιο , ένας οξειδωτικός παράγοντας, μια μικρή ποσότητα κονιοποιημένου γυαλιού που παρέχει την απαραίτητη τριβή ενώ χτυπά, ζωική κόλλα για τη δέσμευση ορισμένων άλλων λειαντικών και πρόσθετες ενώσεις όπως το θείο ή το σουλφίδιο του αντιμονίου (III) που δρουν ως καύσιμο. Το ξύλινο ραβδί έχει επίσης μια συγκεκριμένη ουσία, τυπικά φωσφορικό αμμώνιο , εμποτισμένο στη σύνθεσή του για να καταστέλλει τη μετάλαμψη μόλις πεθάνει η φλόγα. Το άλλο μέρος είναι η εντυπωσιακή επιφάνεια, η οποία συνήθως αποτελείται από κόκκινο φώσφορο, γυαλί σε σκόνη (ή πυρίτιο), συνδετικό υλικό και πληρωτικό.
Τώρα, ας πάμε λίγο πιο βαθιά…
Τι πραγματικά συμβαίνει όταν χτυπάτε έναν αγώνα;
Ασφαλείς αγώνες
Όταν τρίβετε το ραβδί στην επιφάνεια που χτυπά, η τριβή που δημιουργείται προκαλεί μέρος του κόκκινου φωσφόρου να μετατραπεί σε λευκό φώσφορο . Τώρα, ο λευκός φώσφορος είναι εξαιρετικά ευαίσθητος και πτητικός. αναφλέγεται αυθόρμητα στον αέρα, κάνοντας μια φλόγα.

Το τρίψιμο του σπίρτου στην επιφάνεια που χτυπάει παρέχει την απαραίτητη τριβή (Πηγή εικόνας:commons.wikimedia.org)
Μόλις το ραβδί αποκτήσει φλόγα στο ένα άκρο, το μόνο που χρειάζεται είναι να το διατηρήσει παρέχοντάς του περισσότερο οξυγόνο (οξειδωτικό μέσο) από αυτό που μπορεί να πάρει απευθείας από τον αέρα και δίνοντάς του κάτι να κάψει.
Η θερμότητα που απελευθερώνεται κατά την ανάφλεξη διασπά το χλωρικό κάλιο, απελευθερώνοντας πολύ οξυγόνο για να γίνει μεγαλύτερη η φλόγα. Αυτό το οξυγόνο συνδυάζεται με το θείο που περιέχεται στο κεφάλι για να διατηρήσει τη μινιατούρα φωτιάς. Μόλις η φλόγα ζήσει μέσω της αρχικής της φάσης, το μόνο που έχει να κάνει είναι να κάψει το μήκος του ξύλινου ραβδιού παρουσία ατμοσφαιρικού οξυγόνου.
Απαγόρευση-οπουδήποτε ταιριάζει

Ένας αγώνας απεργίας οπουδήποτε
Η διαδικασία που συζητήσαμε εδώ είναι πώς καίγονται τα σπίρτα ασφαλείας. Ωστόσο, υπάρχει μια άλλη παραλλαγή αγώνων, γνωστή ως «strike-anywhere», που είναι ελαφρώς διαφορετική. Σε αντίθεση με το πρώτο, αυτά τα σπίρτα περιέχουν όλα τα αντιδραστικά συστατικά, όπως θείο, χλωρικό κάλιο, κλπ. στο κεφάλι του σπίρτου. Επίσης, συνήθως έχουν σεσκισουλφίδιο φωσφόρου περιλαμβάνονται στα σπιρτόκεφαλα, καθώς αναφλέγεται ευκολότερα με την τριβή παρά ο κόκκινος φώσφορος. Επίσης, σε αντίθεση με τους αγώνες ασφαλείας, αυτοί οι αγώνες δεν χρειάζονται κάποια συγκεκριμένη επιφάνεια χτυπήματος. το σεσκισουλφίδιο του φωσφόρου που υπάρχει έχει αρκετή γροθιά για να αναφλεγεί ακόμη και με τη βοήθεια μιας μικρής τριβής.
Αν κάποιος που δεν έχει ανάψει ποτέ σπίρτο στη ζωή του διάβαζε τις λεπτομέρειες της διαδικασίας ανάμματος ενός σπίρτου, αναμφίβολα θα πίστευε ότι το άναμμα ενός σπίρτου είναι μια μακρόσυρτη διαδικασία, αλλά στην πραγματικότητα, απέχει πολύ από αυτό – με την προϋπόθεση οι αγώνες δεν είναι υγροί και δεν έχει αέρα.




