Γραμμάρια σε κρεατοελιές:Πώς να μετατρέψετε τα γραμμάρια σε κρεατοελιές;
Για να μετατρέψετε τα γραμμάρια σε mole, πρέπει να βρείτε τη μοριακή μάζα της ένωσης και να διαιρέσετε τον αριθμό των γραμμαρίων της ένωσης με τη μοριακή της μάζα.
Η μετατροπή γραμμαρίων σε κρεατοελιές περιλαμβάνει 2 βήματα:
Βήμα 1:Βρείτε τη μοριακή μάζα της ένωσης.
Βήμα 2:Διαιρέστε τον αριθμό των γραμμαρίων της ένωσης με τη μοριακή της μάζα.
Για να προσδιορίσετε τον αριθμό των γραμμομορίων μιας δεδομένης ένωσης, το πρώτο πράγμα που πρέπει να κάνετε είναι να βρείτε τη μοριακή μάζα (ή το μοριακό βάρος) της εν λόγω ένωσης. Μόλις το κάνετε αυτό, πρέπει να προσδιορίσετε πόσο ζυγίζει η ένωση φυσικά (σε γραμμάρια). Αφού λάβετε και τις δύο αυτές τιμές, πρέπει να διαιρέσετε το φυσικό βάρος της ένωσης με το μοριακό της βάρος.
Προτού εμβαθύνουμε στη διαδικασία υπολογισμού της μετατροπής γραμμαρίων σε γραμμομόρια, ας κάνουμε μια γρήγορη ανακεφαλαίωση των βασικών στοιχείων.
Τι είναι το mole στη χημεία;
Ένα mol μιας ουσίας ορίζεται ως η μάζα της ουσίας που περιέχει τον ίδιο αριθμό θεμελιωδών μονάδων με τα άτομα σε ακριβώς 12 γραμμάρια άνθρακα-12, που είναι περίπου 6,022 x 1023 άτομα.
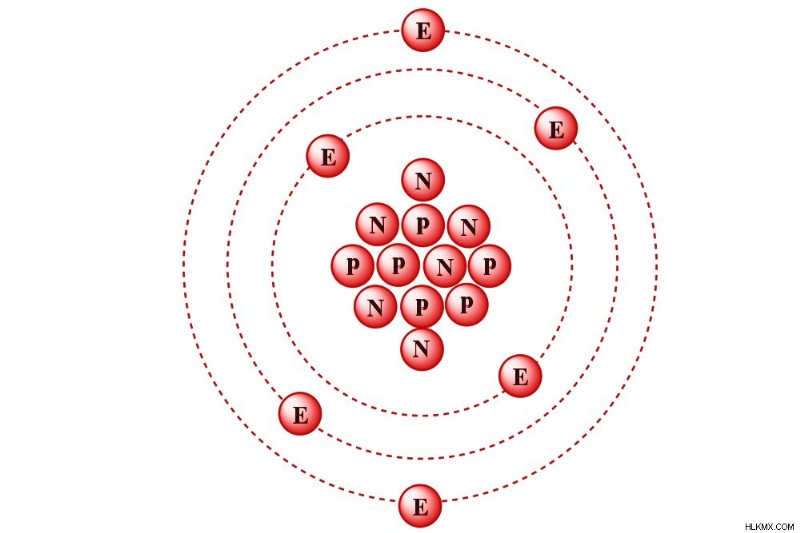
Ο άνθρακας-12 είναι ένα ισότοπο άνθρακα του οποίου ο πυρήνας περιέχει έξι πρωτόνια και έξι νετρόνια.
Θέλω επίσης να αναφέρω έναν ευκολότερο, πιο κατανοητό ορισμό του μωρού (χημείας).
Οι κρεατοελιές είναι μονάδα μέτρησης χημικών ενώσεων. Όπως ακριβώς τα φυσικά μεγέθη, όπως η απόσταση, η μάζα, ο χρόνος κ.λπ. έχουν μονάδες μέτρησης (μέτρα, γραμμάρια, δευτερόλεπτα αντίστοιχα), ομοίως, οι χημικές ουσίες μετρώνται σε mol. Εν ολίγοις, θα μπορούσατε να πείτε ότι ένας «τυφλοπόντικας» είναι η μονάδα ποσότητας στη χημεία, δηλαδή, σας λέει πόση ποσότητα από μια συγκεκριμένη χημική ουσία υπάρχει.
Σημειώστε ότι ο τυφλοπόντικας στη χημεία δεν πρέπει να συγχέεται με τον σπίλο που σχετίζεται με το ανθρώπινο σώμα. Ενώ το πρώτο είναι μονάδα μέτρησης, το δεύτερο είναι ένα σκούρο σημείο στο δέρμα που αποτελείται από κύτταρα δέρματος που έχουν αναπτυχθεί σε μια ομάδα.

Όταν οι χημικοί εκτελούν μια χημική αντίδραση σε ένα εργαστήριο, θέλουν να διασφαλίσουν ότι χρησιμοποιούν τις σωστές ποσότητες όλων των χημικών που εμπλέκονται στην αντίδραση πριν ξεκινήσουν πραγματικά τη διαδικασία. Ακριβώς όπως είναι πολύ πιο απλό και πιο βολικό να μετράτε τις διαγαλαξιακές αποστάσεις σε έτη φωτός αντί για εκατοστά, είναι πιο εύκολο να μετρήσετε τα άτομα σε mole αντί να τα μετρήσετε σε δισεκατομμύρια και τρισεκατομμύρια.
Εδώ είναι ένα ενδιαφέρον πράγμα για τους κρεατοελιές:1 mole οποιουδήποτε στοιχείου ή χημικής ουσίας είναι πάντα ο ίδιος αριθμός. Για παράδειγμα, 1 mole υδρογόνου και 1 mole οξυγόνου περιέχουν και τα δύο περίπου 6.022 x 1023 άτομα. Ωστόσο, οι αντίστοιχες μάζες υδρογόνου και οξυγόνου είναι διαφορετικές.
Το ίδιο ισχύει και στην περίπτωση των χημικών ενώσεων. Ανεξάρτητα από το ποια είναι η μοριακή τους μάζα, όλα περιέχουν τον ίδιο αριθμό μορίων για έναν συγκεκριμένο αριθμό γραμμομορίων, δηλαδή 1 γραμμομόριο γλυκόζης περιέχει τον ίδιο αριθμό μορίων με 1 γραμμομόριο μεθανίου. Οι μάζες τους, ωστόσο, είναι διαφορετικές.
Τώρα που καταλαβαίνουμε τι είναι το mole, ήρθε η ώρα να προχωρήσουμε και να δούμε πώς να προσδιορίσουμε τον αριθμό των σπίλων που υπάρχουν σε μια χημική ένωση, με την προϋπόθεση ότι γνωρίζουμε ήδη το φυσικό βάρος της εν λόγω ένωσης.
Τύπος μετατροπής γραμμάρια σε γραμμομόρια
Το πρώτο βήμα είναι να προσδιορίσετε το μοριακό βάρος (ή τη μοριακή μάζα) της ένωσης με την οποία αντιμετωπίζετε. Μια ένωση αποτελείται από έναν αριθμό ατόμων διαφορετικών στοιχείων και το συνδυασμένο βάρος τους γίνεται το μοριακό βάρος της ένωσης.
Ας εξετάσουμε το παράδειγμα του NaCl (χλωριούχο νάτριο ή κοινό αλάτι) για να κατανοήσουμε καλύτερα αυτήν την έννοια.
Το NaCl αποτελείται από δύο άτομα:νάτριο (Na) και χλωρίδιο (Cl). Η ατομική μάζα του νατρίου είναι 22,98, ενώ η ατομική μάζα του χλωρίου είναι 35,543.
Μοριακή μάζα NaCl =ατομική μάζα νατρίου + ατομική μάζα χλωρίου
Έτσι, η μοριακή μάζα του NaCl αποδεικνύεται ότι είναι 58,52 γραμμάρια/mol.
Έτσι μπορείτε να προσδιορίσετε τη μοριακή μάζα οποιασδήποτε ένωσης.
Στη συνέχεια, πρέπει να βρείτε το «φυσικό» βάρος της εν λόγω ένωσης, το οποίο, σε αυτήν την περίπτωση, είναι το χλωριούχο νάτριο. Μπορείτε να μετρήσετε το βάρος του δείγματός σας χρησιμοποιώντας μια αναλυτική ζυγαριά (που ονομάζεται επίσης "ζυγός εργαστηρίου"), μια συσκευή που ζυγίζει τις ουσίες σε γραμμάρια. Τα περισσότερα εργαστήρια χημείας διαθέτουν αυτήν τη συσκευή για τη μέτρηση του βάρους των χημικών ουσιών.

Αναλυτικό υπόλοιπο Mettler ae-260 (Πιστωτική φωτογραφία :US DEA/Wikimedia Commons)
Ας υποθέσουμε, σε αυτήν την περίπτωση, ότι έχουμε ένα δείγμα 100 γραμμαρίων κοινού αλατιού.
Αφού έχετε και τη μοριακή μάζα και το φυσικό βάρος της ένωσης, μπορείτε να χρησιμοποιήσετε έναν απλό τύπο για να υπολογίσετε τον αριθμό των γραμμομορίων που υπάρχουν στο δείγμα.
Αριθμός moles =Βάρος ένωσης (σε γραμμάρια) / μοριακό βάρος ένωσης

Στο παράδειγμά μας, το βάρος του NaCl είναι 100 γραμμάρια και το μοριακό του βάρος είναι 58,52 g/moles. Έτσι, ο αριθμός των mol στο δεδομένο δείγμα NaCl είναι 1,70 moles (100/58,52).
Ας πάρουμε ένα άλλο παράδειγμα – ένα δείγμα 50 γραμμαρίων νερού (H2O).
Η μοριακή μάζα του νερού είναι 18 g/mol.
Επομένως, ο αριθμός των γραμμομορίων σε αυτό το δείγμα νερού είναι 2,78 moles (50/18).
Χρησιμοποιώντας αυτόν τον τύπο, μπορείτε να προσδιορίσετε τον αριθμό των mole που υπάρχουν σε ένα δεδομένο δείγμα οποιασδήποτε ένωσης.




