Πώς λειτουργεί ένα γαλβανικό κύτταρο;
Ένα γαλβανικό ή βολταϊκό στοιχείο είναι ένα ηλεκτροχημικό στοιχείο που μετατρέπει τη χημική ενέργεια σε ηλεκτρική ενέργεια. Αυτό το επιτυγχάνει αξιοποιώντας την ενέργεια που παράγεται από τις αντιδράσεις οξειδοαναγωγής που συμβαίνουν μέσα στο κύτταρο. Για να κατανοήσουμε λεπτομερώς αυτήν τη λειτουργία, πρέπει πρώτα να καταλάβουμε τι είναι μια αντίδραση οξειδοαναγωγής.
Τι είναι η αντίδραση οξειδοαναγωγής;
Η λέξη «οξειδοαναγωγή» είναι σύντομη για «αναγωγή-οξείδωση». Η συνδυαστική φράση αντιπροσωπεύει δύο χημικές αντιδράσεις που συμβαίνουν ταυτόχρονα για την ανταλλαγή ηλεκτρονίων. Το αντιδραστήριο που χάνει τα ηλεκτρόνια του λέγεται ότι οξειδώνεται, ενώ το αντιδρών που αποκτά αυτά τα ίδια ηλεκτρόνια λέγεται ότι είναι ανηγμένο. Σημειώστε ότι το ένα προκαλεί το άλλο και είναι αυτή η αιτιακή φύση της αντίδρασης που δίνει το όνομά της στην αντίδραση "red-ox".
Εδώ είναι ένα απλό πείραμα που απεικονίζει μια αντίδραση οξειδοαναγωγής.
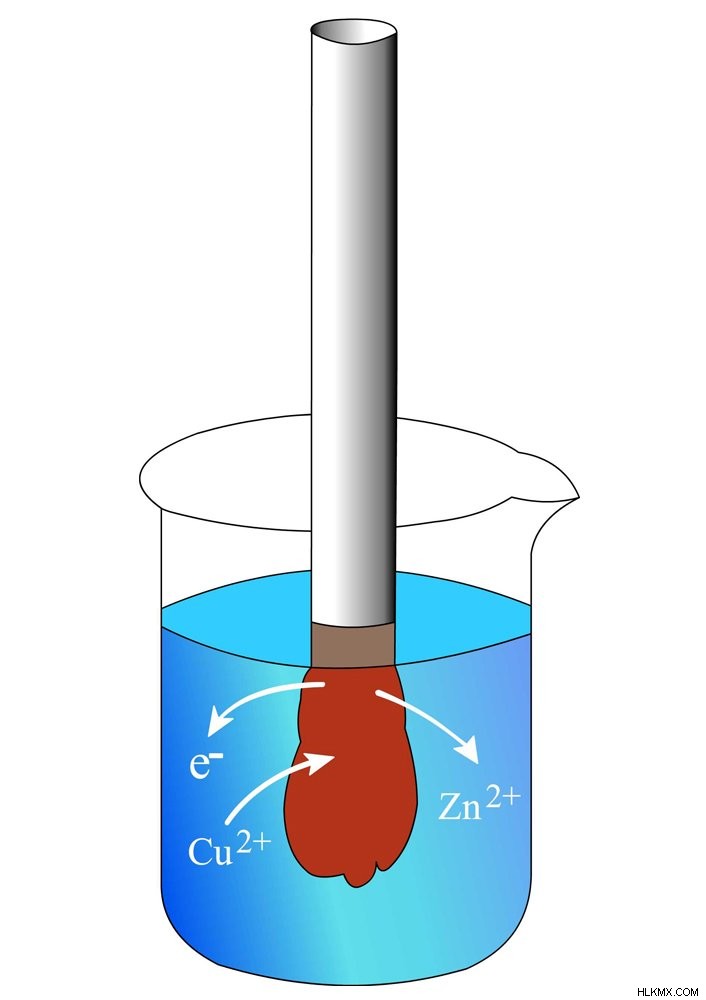 Το ποτήρι περιέχει ένα διάλυμα θειικού χαλκού (CuSo4), στο οποίο βυθίζεται μια λωρίδα ψευδαργύρου. Ο χαλκός είναι πιο ηλεκτραρνητικός από τον ψευδάργυρο, που σημαίνει ότι παρουσιάζει μεγαλύτερη τάση να έλκει ηλεκτρόνια και να σχηματίζει αρνητικά ιόντα χαλκού. Μόλις η λωρίδα βυθιστεί στο διάλυμα, τα ιόντα χαλκού (Cu2+) καταλαμβάνουν τα ηλεκτρόνια του ψευδαργύρου για να σχηματίσουν άτομα χαλκού (Cu), τα οποία εναποτίθενται ως καφετί στοιβάδα στη λωρίδα, ενώ τα άτομα ψευδαργύρου (Zn), τώρα στερούνται ηλεκτρόνια, γίνονται ιόντα ψευδαργύρου (Zn2+), τα οποία διαλύονται στο διάλυμα. Στο τέλος της αντίδρασης, η λωρίδα έχει γίνει βαρύτερη και το διάλυμα είναι γεμάτο με ψευδάργυρο.
Το ποτήρι περιέχει ένα διάλυμα θειικού χαλκού (CuSo4), στο οποίο βυθίζεται μια λωρίδα ψευδαργύρου. Ο χαλκός είναι πιο ηλεκτραρνητικός από τον ψευδάργυρο, που σημαίνει ότι παρουσιάζει μεγαλύτερη τάση να έλκει ηλεκτρόνια και να σχηματίζει αρνητικά ιόντα χαλκού. Μόλις η λωρίδα βυθιστεί στο διάλυμα, τα ιόντα χαλκού (Cu2+) καταλαμβάνουν τα ηλεκτρόνια του ψευδαργύρου για να σχηματίσουν άτομα χαλκού (Cu), τα οποία εναποτίθενται ως καφετί στοιβάδα στη λωρίδα, ενώ τα άτομα ψευδαργύρου (Zn), τώρα στερούνται ηλεκτρόνια, γίνονται ιόντα ψευδαργύρου (Zn2+), τα οποία διαλύονται στο διάλυμα. Στο τέλος της αντίδρασης, η λωρίδα έχει γίνει βαρύτερη και το διάλυμα είναι γεμάτο με ψευδάργυρο.

Στη γρήγορη αντίδραση μεταξύ των μετάλλων, ο χαλκός μειώνεται καθώς αποκτά ηλεκτρόνια, ενώ ο ψευδάργυρος οξειδώνεται καθώς χάνει ηλεκτρόνια (θυμηθείτε το OIL RIG). Ο ηλεκτρισμός είναι απλώς η ροή των ηλεκτρονίων — τα ηλεκτρόνια που ανταλλάσσονται στην αντίδραση μπορούν να χρησιμοποιηθούν, ας πούμε, για να τροφοδοτήσουν έναν λαμπτήρα, αλλά αυτό δεν μπορεί να επιτευχθεί στο ποτήρι ζέσεως, γιατί τα ηλεκτρόνια σε αυτό διασκορπίζονται απρόσεκτα. Για να τα αξιοποιήσουμε, πρέπει με κάποιο τρόπο, προτού καταληφθούν από χαλκό, να δρομολογήσουμε κάθε ηλεκτρόνιο στον βολβό. Αυτό μπορεί να επιτευχθεί με όχι ένα, αλλά δύο ποτήρια.
Διάγραμμα γαλβανικών κυττάρων
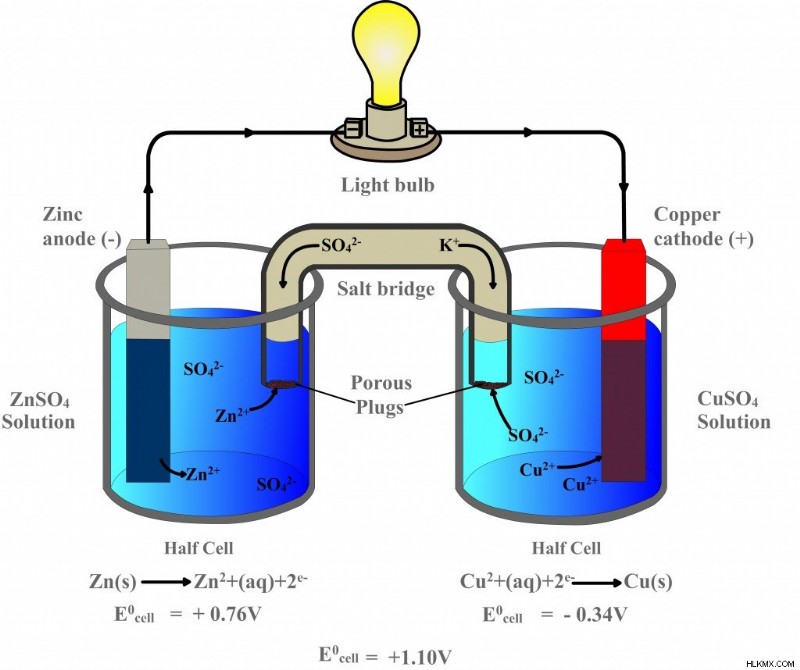
Τώρα, σκεφτείτε αυτήν τη συσκευή, η οποία αντιπροσωπεύει ένα γαλβανικό στοιχείο.
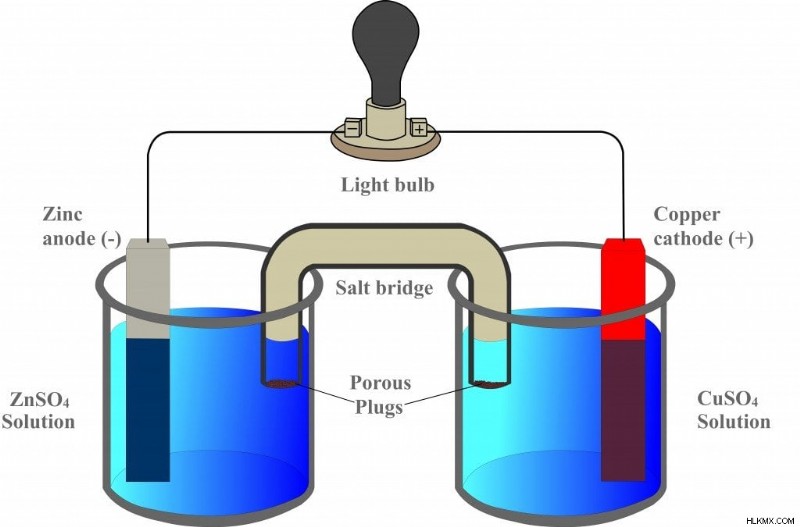
Το πρώτο ποτήρι περιέχει θειικό ψευδάργυρο (ZnSO4) στον οποίο βυθίζεται μια λωρίδα ψευδαργύρου, ενώ το διπλανό ποτήρι περιέχει θειικό χαλκό (CuSO4) στον οποίο βυθίζεται μια λωρίδα χαλκού. Ωστόσο, οι δύο λωρίδες συνδέονται με ένα εξωτερικό κύκλωμα, έναν αγωγό, ο οποίος συνδέεται με έναν λαμπτήρα.
Το κύτταρο ονομάζεται «γαλβανικό» από τον εφευρέτη του, τον φυσικό Luigi Galvani. Το 1780, ο Galvani έδειξε ότι όταν δύο διαφορετικά μέταλλα συνδέονται μεταξύ τους στο ένα άκρο, ενώ τα άλλα άκρα συνδέονται με τα πόδια ενός βατράχου, τα πόδια συστέλλονται, υποδεικνύοντας τη ροή του ηλεκτρισμού. Ονόμασε την παράλογη συσκευή του «κύκλωμα ζώων». Ωστόσο, για να αμφισβητήσει τον Galvani, ο Alessandro Volta ανέπτυξε το ίδιο κύτταρο χωρίς ούτε ένα βιολογικό συστατικό. Αυτό ήταν ένα απίστευτο επίτευγμα και, για αυτόν τον λόγο, τα «γαλβανικά» και τα «βολταϊκά» χρησιμοποιούνται ως συνώνυμα.
Παρόλο που τα κυκλώματά τους λειτουργούσαν, οι εφευρέτες ήταν λανθασμένοι σχετικά με το γιατί δούλεψαν. Ο Galvani πίστευε ότι ο βάτραχος ήταν υπεύθυνος, ενώ ο Volta πίστευε ότι ήταν οι ιδιότητες των απομονωμένων μετάλλων. Ήταν ο Faraday που τελικά είχε δίκιο όταν συνειδητοποίησε ότι η ηλεκτρική ενέργεια προερχόταν από χημικές αντιδράσεις, ότι η πηγή της τάσης ήταν καθαρά χημική. Ήταν ο Faraday που επινόησε τους όρους που τώρα σχηματίζουν ηλεκτρική και ηλεκτρονική ορολογία:τα μέταλλα που ονόμασε ηλεκτρόδια – κάθοδος και άνοδος , το διάλυμα στο οποίο βυθίστηκαν το ονόμασε ηλεκτρολύτη, και τις εμπλεκόμενες οντότητες ονόμασε ions – κατιόντα και ανιόντα .
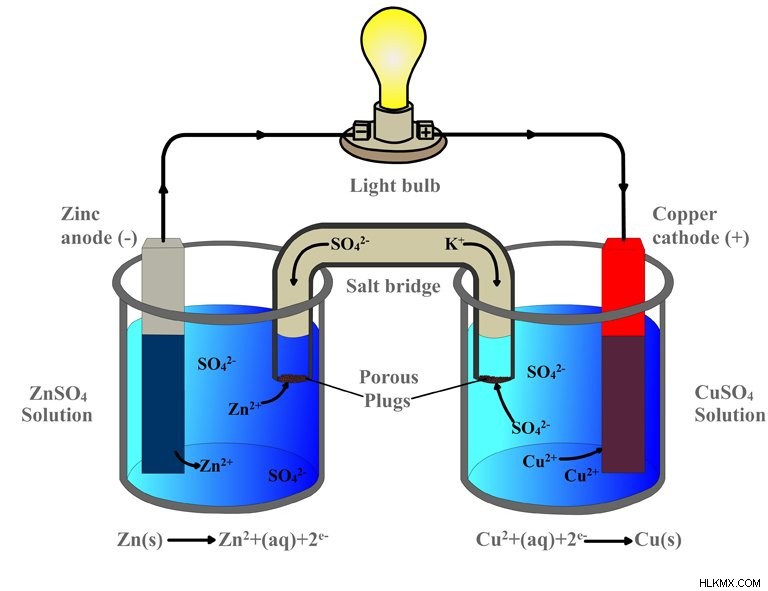
Μόλις τα ηλεκτρόδια ψευδαργύρου και χαλκού βυθιστούν στους αντίστοιχους θειικούς ηλεκτρολύτες τους, αρχίζει η αντίδραση οξειδοαναγωγής:ο χαλκός αρχίζει να δελεάζει τα ηλεκτρόνια του ψευδαργύρου. Ακριβώς όπως συνέβη στο πείραμα ενός ποτηριού, τα άτομα ψευδαργύρου στο πρώτο ποτήρι οξειδώνονται και επομένως χάνουν τα ηλεκτρόνια τους και γίνονται ιόντα ψευδαργύρου, τα οποία διαλύονται στο διάλυμα θειικού ψευδαργύρου. Τα ιόντα χαλκού στο διπλανό ποτήρι μειώνονται καθώς αποκτούν αυτά τα ηλεκτρόνια και γίνονται άτομα χαλκού, τα οποία εναποτίθενται στη λωρίδα.
Ωστόσο, ενώ τα δύο ποτήρια ζέσεως είναι φυσικά διαχωρισμένα, τα ηλεκτρόδια συνδέονται με έναν εξωτερικό αγωγό. Τα ηλεκτρόνια, αντί να διασπείρονται, δρομολογούνται στο χάλκινο ηλεκτρόδιο μέσω αυτού του αγωγού. Ωστόσο, επειδή πάνω σε αυτόν τον αγωγό είναι σκαρφαλωμένος ένας λαμπτήρας, πριν φτάσουν στη χάλκινη λωρίδα, τα ηλεκτρόνια δεν έχουν άλλη επιλογή παρά να περάσουν μέσα από τον βολβό. Το ηλεκτρόδιο ψευδαργύρου, δεδομένου ότι τροφοδοτεί τα ηλεκτρόνια, είναι η άνοδος της μπαταρίας ή ο αρνητικός ακροδέκτης, ενώ το ηλεκτρόδιο χαλκού, που έλκει ή λαμβάνει τα ηλεκτρόνια, είναι η κάθοδος της μπαταρίας ή ο θετικός ακροδέκτης. Επειδή ένα μέταλλο είναι δεσμευμένο να κλέψει ηλεκτρόνια από το άλλο μέταλλο (ή μη μέταλλο), η ηλεκτραρνητικότητα καθορίζει την κατεύθυνση του ρεύματος του κυκλώματος.
(Φωτογραφία:Wikimedia Commons)
Ωστόσο, οι ετικέτες συμμορφώνονται με την τυπική σύμβαση. Η άνοδος της μπαταρίας, η λωρίδα ψευδαργύρου – και αυτό μπορεί να μπερδέψει τον αναγνώστη – είναι στην πραγματικότητα θετική, αφού στερείται ηλεκτρονίων λόγω οξείδωσης, ενώ η κάθοδος της μπαταρίας, η χάλκινη λωρίδα, είναι στην πραγματικότητα αρνητική, καθώς είναι άφθονη σε ηλεκτρόνια λόγω μείωση. Ο ψευδάργυρος είναι το θετικό ηλεκτρόδιο, αλλά το αρνητικό τερματικό, ενώ ο χαλκός είναι το αρνητικό ηλεκτρόδιο, αλλά το θετικό τερματικό . Αυτή η διάκριση είναι κρίσιμη.
Τι είναι η Salt Bridge;
Παρόλο που τα ηλεκτρόνια ρέουν επιτυχώς μέσω του αγωγού και επομένως του λαμπτήρα, ο λαμπτήρας δεν θα ανάψει, επειδή το κύκλωμα είναι ακόμα ατελές. Αυτό που συμπληρώνει το κύκλωμα είναι ο σωλήνας στο διάγραμμα, του οποίου τα πόδια είναι βυθισμένα και στα δύο ποτήρια. Αυτό ονομάζεται γέφυρα αλατιού. Η γέφυρα άλατος είναι μια πορώδης ουσία που αποτελείται από ένα άλας στο οποίο τα ηλεκτρόνια δεν μπορούν να ταξιδέψουν, αλλά τα κατιόντα και τα ανιόντα μπορούν. Με την απαγόρευση της ροής των ηλεκτρονίων, αποκλείεται αυτόματα από τη συμμετοχή ή την παρέμβαση στη διαδικασία. Ο μοναδικός σκοπός του είναι να ανταλλάξει ιόντα και να ολοκληρώσει το κύκλωμα.
Όταν ο ψευδάργυρος οξειδώνεται και διαλύεται στο διάλυμα ως κατιόν ψευδάργυρου, το κατιόν ψευδάργυρου διασχίζει τη γέφυρα και εισέρχεται στο παρακείμενο ποτήρι ζέσεως. Εκεί σχηματίζει θειικό ψευδάργυρο αντικαθιστώντας το κατιόν του χαλκού, το οποίο, αναμεμειγμένο με το θειικό ανιόν, πριν αναχθεί σχημάτιζε το διάλυμα θειικού χαλκού. Ομοίως, όταν το κατιόν του χαλκού ανάγεται για να σχηματίσει ένα άτομο χαλκού, το θειικό ανιόν που μένει πίσω διασχίζει τη γέφυρα και εισέρχεται στο πρώτο ποτήρι. Εκεί συνδυάζεται με τα οξειδωμένα κατιόντα ψευδαργύρου για να σχηματίσει θειικό ψευδάργυρο. Η ανταλλαγή διασφαλίζει ότι η αντίδραση είναι ισορροπημένη ή ότι το κύκλωμα έχει ολοκληρωθεί. Η αναπαράσταση μιας γαλβανικής κυψέλης ή των δύο ποτηριών που συνδέονται με μια πορώδη γέφυρα αλατιού μπορεί να περιοριστεί περαιτέρω σε αυτό:
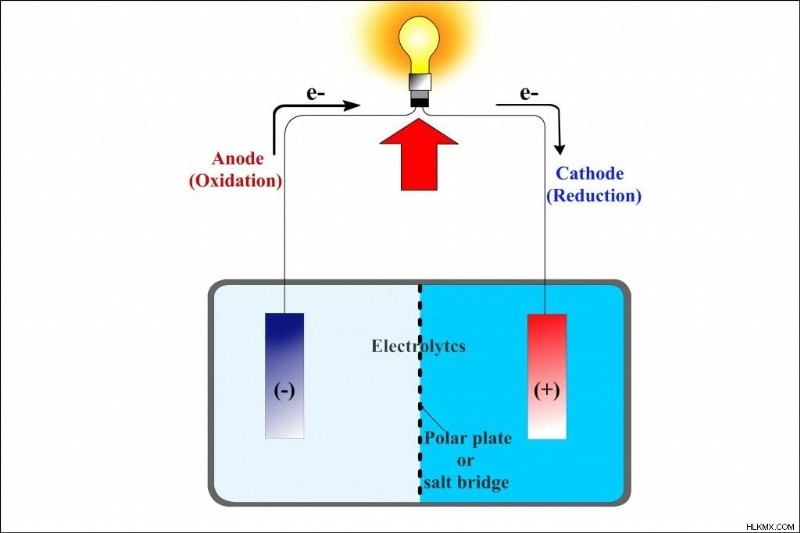
Καθώς οι αντιδράσεις αναγωγής και οξείδωσης συμβαίνουν φυσικώς διαχωρισμένες σε δύο διαφορετικά ποτήρια, κάθε ποτήρι ή μονάδα ονομάζεται μισό κύτταρο. Η φύση της τάσης, λόγω της μοναδικής κατεύθυνσης της ροής των ηλεκτρονίων, είναι DC. Το μέγεθος αυτής της τάσης συνεχούς ρεύματος είναι η αριθμητική διαφορά των τάσεων στα δύο μισά κελιά. Η διαφορά δίνει ένα σχετικό μέτρο της ευκολίας διάλυσης των δύο ηλεκτροδίων στον ηλεκτρολύτη. Επομένως, η τάση είναι συνάρτηση των ιδιοτήτων τόσο των ηλεκτροδίων και τον ηλεκτρολύτη. Θυμηθείτε – και αξίζει να αναφέρουμε ξανά – ότι η τάση είναι καθαρά χημική.
Οι μπαταρίες σήμερα δεν φιλοξενούν ούτε ένα γαλβανικό στοιχείο, αλλά ένα ζευγάρι, ή δύο από αυτές σε σειρά. Μια μπαταρία 12 V αποτελείται συνήθως από 6 γαλβανικές κυψέλες. Η μπαταρία «πεθαίνει» όταν το σύνολο των ανιόντων της έχει διαλυθεί στον ηλεκτρολύτη, ενώ το σύνολο των κατιόντων της έχει αποτεθεί στο ηλεκτρόδιο. Λάβετε υπόψη ότι δεν χρησιμοποιούν όλες οι μπαταρίες ψευδάργυρο, χαλκό και τα θειικά τους ως ηλεκτρόδια και ηλεκτρολύτη. Αυτό που είναι απαραίτητο είναι η διαφορά στην ηλεκτραρνητικότητα των ηλεκτροδίων.
Η πλειοψηφία των μπαταριών βασίζονται στην πραγματικότητα σε μόλυβδο και οξείδιο μολύβδου ως άνοδο και κάθοδο, αντίστοιχα. Ακόμη και η γέφυρα αλατιού δεν χρειάζεται απαραίτητα να αποτελείται από το ίδιο αλάτι που σχηματίζουν τα μέταλλα. Χρειάζεται απλώς να παρέχει τον απαραίτητο αριθμό κατιόντων και ανιόντων για να εξισορροπηθεί η αντίδραση. Στο παράδειγμά μας, εάν αποτελούταν από κάλιο, θα δώριζε δύο κατιόντα καλίου για ένα μόνο κατιόν ψευδαργύρου.
 Γαλβανικό στοιχείο έναντι ηλεκτρολυτικού κυττάρου
Γαλβανικό στοιχείο έναντι ηλεκτρολυτικού κυττάρου
Τέλος, όταν πεθάνουν, τα γαλβανικά κύτταρα δεν μπορούν να αναζωογονηθούν ή να επαναφορτιστούν. Αυτός είναι ο λόγος που κάποιος πρέπει να αλλάζει κατά διαστήματα τις μπαταρίες σε ένα ξυπνητήρι ή στο τηλεχειριστήριο. Το είδος του ηλεκτροχημικού στοιχείου που μπορεί να επαναφορτιστεί είναι ένα ηλεκτρολυτικό στοιχείο. Ένα ηλεκτρολυτικό στοιχείο αποτελείται επίσης από δύο ποτήρια γεμάτα με ηλεκτρολύτες στους οποίους βυθίζονται ηλεκτρόδια, αλλά επιτυγχάνει το πλήρες αντίστροφο αυτού που κάνει ένα γαλβανικό στοιχείο:μετατρέπει την ηλεκτρική ενέργεια σε χημική ενέργεια.
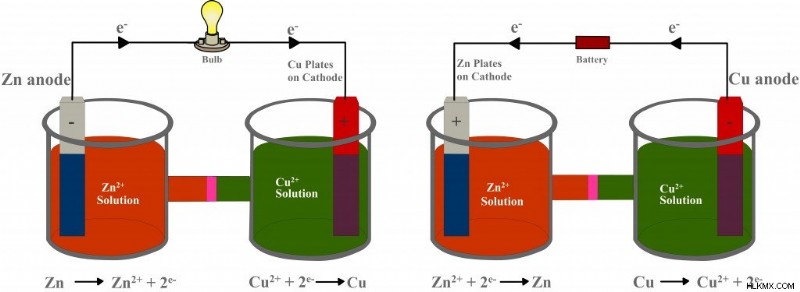
Τα ηλεκτρόδια συνδέονται με μια ηλεκτρική πηγή μέσω ενός εξωτερικού κυκλώματος. Ωστόσο, το δυναμικό που δημιουργείται από αυτή την πηγή είναι μεγαλύτερο από το δυναμικό που δημιουργείται από την αντίδραση οξειδοαναγωγής. Επιπλέον, η πηγή είναι εγκατεστημένη στο απέναντι κατεύθυνση. Επομένως, ως αποτέλεσμα του μεγαλύτερου δυναμικού του, υπερνικά τη δύναμη των εισερχόμενων ηλεκτρονίων και τα αναγκάζει να αντιστρέψουν την κατεύθυνσή τους. Στη συνέχεια, τα ηλεκτρόνια ρέουν από τη χάλκινη λωρίδα στη λωρίδα ψευδαργύρου, έτσι ώστε ο χαλκός τώρα οξειδώνεται και ο ψευδάργυρος ανάγεται. Με αυτόν τον τρόπο, σε αντίθεση με ένα γαλβανικό στοιχείο, το οποίο παράγει ρεύμα από μια αντίδραση οξειδοαναγωγής, ένα ηλεκτρολυτικό στοιχείο χρησιμοποιεί ηλεκτρικό ρεύμα για να οδηγήσει μια αντίδραση οξειδοαναγωγής. Αργότερα, η μπαταρία μπορεί να αντικατασταθεί με έναν λαμπτήρα, καθιστώντας το στοιχείο γαλβανικό, μόνο πλήρως φορτισμένο.




