Τι είναι ο νόμος του Henry;
Ο νόμος του Henry είναι η μαθηματική σχέση μεταξύ της μερικής πίεσης ενός αερίου και της συγκέντρωσης αυτού του αερίου σε ένα διάλυμα. Ο νόμος ορίζει ότι η ποσότητα του αερίου που διαλύεται σε ένα διάλυμα είναι ανάλογη με τη μερική πίεση αυτού του αερίου.
Είναι αλήθεια ότι οι εξισώσεις για τα μαθηματικά μπορεί να αποδειχθούν εξαιρετικά ξηρές και εγκόσμιες. Μερικές φορές μπορεί να οδηγήσουν σε τόσο υψηλό επίπεδο αφηρημένης σκέψης που αυτές οι έννοιες και οι εξισώσεις χάνουν κάθε είδους συσχέτιση με τον πραγματικό κόσμο. Αυτό ισχύει ιδιαίτερα για τον νόμο του Henry, καθώς είναι εξαιρετικά αφηρημένος. Ωστόσο, υπάρχει ένας λόγος που ονομάζεται «Νόμος», δηλαδή επειδή εξηγεί τα φαινόμενα της φύσης με τον πιο επιστημονικό και μαθηματικά ακριβή τρόπο. Τώρα, ας προσπαθήσουμε να δημιουργήσουμε μια βασική κατανόηση του νόμου του Henry.
Θεωρητική κατανόηση
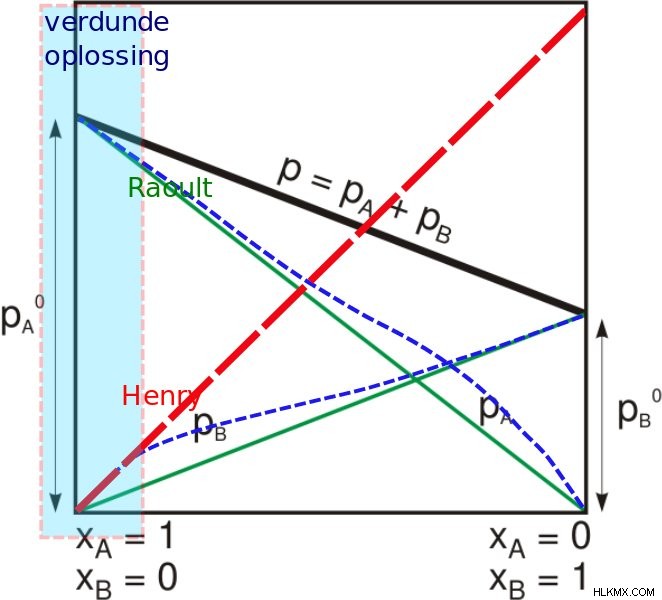
(Φωτογραφία:Jcwf/Wikimedia Commons)
Όταν το αέριο έρχεται σε επαφή με την επιφάνεια ενός υγρού, η ποσότητα του αερίου που θα εισέλθει στο διάλυμα είναι ανάλογη της μερικής πίεσης αυτού του αερίου. Για ανάλυση, ας υποθέσουμε ότι λίγο αέριο και το υγρό είναι νερό. Η ποσότητα του αερίου που διαλύεται σε μια συγκεκριμένη θερμοκρασία εξαρτάται από τη μερική πίεση που ασκεί το αέριο στο υγρό. Ένα απλό πράγμα που πρέπει να θυμόμαστε είναι ότι το διαλυμένο αέριο και το αδιάλυτο αέριο βρίσκονται σε ισορροπία. Μια απλούστερη λογική για τον νόμο του Henry είναι ότι εάν η μερική πίεση ενός αερίου είναι διπλάσια, τότε κατά μέσο όρο, διπλάσιος αριθμός αερίων μορίων θα χτυπήσει στην επιφάνεια του νερού. Για ένα μείγμα αερίων, ο νόμος του Henry βοηθά στην πρόβλεψη της ποσότητας αερίου (ή ακόμα και πολλαπλών αριθμών αερίων) που θα εισέλθει στο διάλυμα, αλλά διαφορετικά αέρια έχουν διαφορετικά επίπεδα διαλυτότητας, γεγονός που επηρεάζει επίσης τον ρυθμό.
Η εξίσωση
Τώρα που έχουμε κατανοήσει μια ενιαία ευρεία εφαρμογή του Νόμου του Henry, ας πάρουμε μια πιο αυστηρή μαθηματική προσέγγιση για την κατανόηση του νόμου του Henry. Ένα αέριο και ένα υγρό θα φτάσουν σε κάποια σχέση ισορροπίας.
Υγρό ⇔ Αέριο
CsHe =Pi
Τα διαφορετικά στοιχεία συμβολίζονται με τις ακόλουθες συντομογραφίες:
Cs =συγκέντρωση κορεσμού
Αυτός =Συντελεστής νόμου του Henry
Pi=μερική πίεση του αερίου
Η τυπική μονάδα για τον συντελεστή νόμου του Henry (He) εκφράζεται σε atm⋅m3/mole. Το P είναι σε atm και για την περιεκτικότητα κορεσμού, το Cs είναι σε mole/m3. Όσο μεγαλύτερος είναι ο συντελεστής του νόμου του Henry, τόσο μεγαλύτερη είναι η μεταβλητότητα και τόσο λιγότερη διαλυτότητα. Ισχύει για αραιωμένα διαλύματα και αέρια που δεν αντιδρούν σε πίεση και θερμοκρασία κοντά στο περιβάλλον. Η ιοντική ισχύς αυξάνει τον συντελεστή Henry και μειώνει τη διαλυτότητα του αερίου.
Διαλυμένο οξυγόνο στο νερό και ισορροπία
Θα εξετάσουμε ένα πολύ πρακτικό παράδειγμα, ώστε να κατανοήσουμε τη φυσική σχέση της προαναφερθείσας εξίσωσης με τον πραγματικό κόσμο. Ας πάρουμε μια συγκεκριμένη περίπτωση οξυγόνου που διαλύεται στο νερό. Τώρα, το οξυγόνο που είναι διαλυμένο έχει δημιουργηθεί κυρίως για δύο λόγους. Ο πρώτος λόγος είναι ότι είναι το υποπροϊόν της φωτοσύνθεσης των υδρόβιων φυτών. Το δεύτερο είναι μέσω της άμεσης απορρόφησης από την ατμόσφαιρα.
Για να είναι η συγκέντρωση οξυγόνου του νερού σε ισορροπία με την ατμόσφαιρα, η συγκέντρωση μπορεί να υπολογιστεί με τον νόμο του Henry. Η σταθερά ισορροπίας για το O2 είναι 769,23. Η σταθερά ισορροπίας του οξυγόνου στο νερό είναι 0,00027. Αυτή είναι η σταθερά ισορροπίας μόνο στην επιφάνεια του νερού. Το νερό κάτω από τη διεπιφάνεια αέρα/νερού δεν βρίσκεται απαραίτητα σε ισορροπία με το οξυγόνο στην ατμόσφαιρα και μπορεί να περιέχει σταθερές ισορροπίας διαφορετικές από αυτές που υποδεικνύονται. Είναι γνωστό ότι η συγκέντρωση οξυγόνου στην επιφάνεια των λιμνών και των ωκεανών είναι υψηλότερη από ότι σε μεγαλύτερα βάθη. Ένα σημαντικό πράγμα που πρέπει να γνωρίζετε για τη σχέση οξυγόνου/νερού είναι το ποσοστό κορεσμού . Το ποσοστό κορεσμού είναι η ποσότητα οξυγόνου που μπορεί να χωρέσει ένα λίτρο νερού σε σχέση με τη συνολική ποσότητα οξυγόνου που μπορεί να κρατήσει το νερό σε αυτήν τη θερμοκρασία.
Το τρεχούμενο νερό σε ρηχά ρεύματα έχει καλύτερη συγκέντρωση οξυγόνου από το στάσιμο νερό, καθώς μπορεί να αναμιχθεί καλά με τον αέρα. Υπάρχει επίσης μια ισχυρή εξάρτηση μεταξύ της θερμοκρασίας και της συγκέντρωσης οξυγόνου. Η ατμοσφαιρική πίεση είναι χαμηλότερη σε μεγαλύτερα υψόμετρα, επομένως το νερό σε υψηλότερα υψόμετρα διατηρεί λιγότερο διαλυμένο οξυγόνο από το νερό στο επίπεδο της θάλασσας. Η ποσότητα του διαλυμένου οξυγόνου είναι υψηλότερη κατά τη διάρκεια της ημέρας, καθώς τότε οι φωτοσυνθετικοί οργανισμοί παράγουν οξυγόνο. Καθώς η θερμοκρασία του νερού αυξάνεται, η ικανότητά του να διαλύει το οξυγόνο στον εαυτό του γίνεται πιο δύσκολη. Αυτό μπορεί να αποδειχθεί ιδιαίτερα επικίνδυνο για τα υδρόβια ζώα, καθώς είναι επιρρεπή σε χαμηλότερα επίπεδα οξυγόνου κατά τη διάρκεια της ημέρας ή τις ζεστές μέρες του καλοκαιριού. Υπάρχουν και άλλες εφαρμογές του νόμου του Henry, όπως ο κορεσμός του διοξειδίου του άνθρακα στο νερό, ακόμη και οι υπολογισμοί του οξυγόνου στην ανθρώπινη κυκλοφορία του αίματος. Ο νόμος του Henry αποδεικνύει ότι ακόμη και οι πιο αφηρημένες έννοιες έχουν τις πιο βασικές πρακτικές εφαρμογές.




