Ο νόμος του Gay-Lussac:Πώς ποικίλλει η πίεση ενός αερίου ανάλογα με τη θερμοκρασία του;
Ο νόμος του Gay-Lussac δηλώνει, «Σε σταθερό όγκο, η πίεση ενός αερίου είναι ευθέως ανάλογη με την απόλυτη θερμοκρασία του σε Kelvin».
Όλα τα δοχεία αεροζόλ συνοδεύονται από μια προειδοποιητική ετικέτα που γράφει «Προστατεύστε από την ηλιακή ακτινοβολία και μην εκθέτετε σε θερμοκρασίες άνω των 50°C». Όταν ένα δοχείο αερολύματος εκτίθεται σε υψηλές θερμοκρασίες, η πίεση του αερίου στο εσωτερικό του αυξάνεται. Μετά από κάποιο χρονικό διάστημα, επιτυγχάνεται ένα σημείο όπου το δοχείο δεν μπορεί πλέον να συγκρατήσει το αέριο υψηλής πίεσης και τελικά εκρήγνυται.
Τα δοχεία αεροζόλ εκρήγνυνται επειδή η πίεση και η θερμοκρασία ενός αερίου συνδέονται στενά μεταξύ τους. Ο νόμος του Gay-Lussac περιγράφει αυτή τη σχέση μεταξύ της θερμοκρασίας και της πίεσης ενός αερίου.
Τύπος νόμου για τους ομοφυλόφιλους Lussac
Ο νόμος του Gay-Lussac λέει, «Η πίεση ενός ιδανικού αερίου είναι ευθέως ανάλογη με την απόλυτη θερμοκρασία του όταν ο όγκος διατηρείται σταθερός». Ο νόμος εκφράζεται μαθηματικά ως,
P ∝ T
P =kT
Όπου P είναι η πίεση του αερίου και συνήθως μετριέται σε atm ή mm Hg, T είναι η απόλυτη θερμοκρασία του αερίου σε Kelvin και k είναι η σταθερά της αναλογικότητας.

Παραμερίστε τον Captain America και τον Bucky, η πίεση και η θερμοκρασία είναι οι πραγματικοί στόχοι φιλίας.
Ας ρίξουμε μια ματιά στον τρόπο με τον οποίο ορίζονται και μετρούνται η θερμοκρασία και η πίεση ενός αερίου για να κατανοήσουμε πλήρως τον νόμο.
Η κινητική θεωρία των αερίων ορίζει τη θερμοκρασία ως τη μέση κινητική ενέργεια των μορίων του αερίου. Η θεωρία υποθέτει τα αέρια ως μια συλλογή μικροσκοπικών σωματιδίων (άτομα στην περίπτωση μονοατομικών αερίων και μόρια στην περίπτωση διατομικών αερίων) που βρίσκονται σε σταθερή κατάσταση κίνησης. Η κίνηση είναι εντελώς τυχαία και προχωρά με γρήγορο ρυθμό. Θεωρείται επίσης ότι τα σωματίδια συγκρούονται συνεχώς μεταξύ τους και τα τοιχώματα του δοχείου στο οποίο περιέχονται.

Τα μόρια ενός αερίου υποτίθεται ότι βρίσκονται σε σταθερή κατάσταση τυχαίας κίνησης και ότι συγκρούονται με τα τοιχώματα του δοχείου. (Φωτογραφία:A. Greg/Wikimedia Commons)
Η κινητική ενέργεια ενός μόνο μορίου δίνεται ως το μισό του γινόμενου της μάζας και της ταχύτητάς του στο τετράγωνο (K.E =mv2/2). Δεδομένου ότι η θερμοκρασία ορίζεται ως το μέτρο της μέσης μεταφορικής κινητικής ενέργειας των μορίων, η θερμοκρασία και η κίνηση των μορίων ενός αερίου είναι ανάλογες μεταξύ τους.
T ∝ mv2/2
Όπου T είναι η θερμοκρασία, το m είναι η μάζα ενός μόνο μορίου και το v αντιπροσωπεύει την ταχύτητα κίνησής του.
Καθώς η μάζα ενός μορίου είναι σταθερή, η κινητική ενέργεια μπορεί να αυξηθεί μόνο εάν αυξηθεί η ταχύτητα του μορίου. Έτσι, μια αύξηση της θερμοκρασίας οδηγεί σε αύξηση της ταχύτητας των μορίων. Στα θερμά αέρια, τα μόρια κινούνται με ταχύτερο ρυθμό σε σύγκριση με τα μόρια στα ψυχρά αέρια.
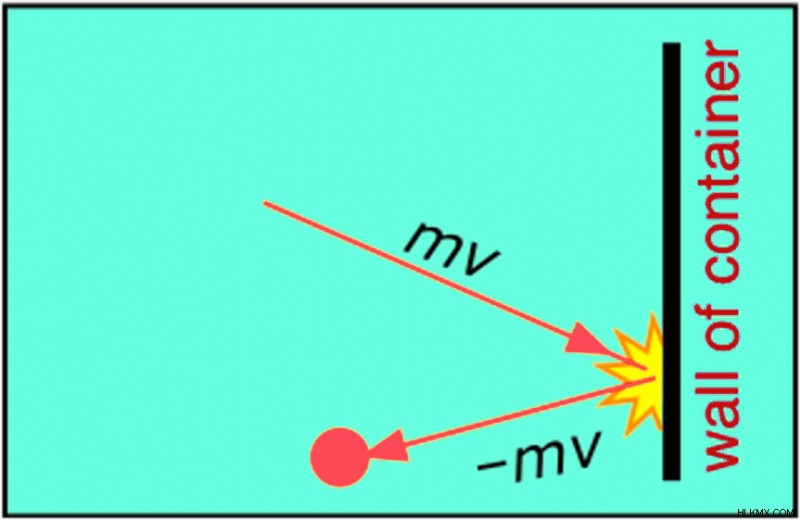
Ένα μόριο αερίου χτυπά τα τοιχώματα ενός δοχείου με ορμή mv (m είναι η μάζα του μορίου και v είναι η ταχύτητά του). Το αρνητικό πρόσημο υποδηλώνει ότι τα μόρια αναπηδούν με την ίδια ταχύτητα αλλά σε αντίθετη κατεύθυνση αφού χτυπήσουν στον τοίχο.
Η πίεση, από την άλλη πλευρά, ορίζεται ως η δύναμη που εφαρμόζεται/ασκείται ανά περιοχή από τα μόρια του αερίου στα τοιχώματα του δοχείου. Καθώς αυξάνεται η θερμοκρασία, αυξάνεται και η ταχύτητα με την οποία τα μόρια χτυπούν τα τοιχώματα του δοχείου. Έτσι, με τη θερμοκρασία, αυξάνεται επίσης η δύναμη που ασκούν τα μόρια του αερίου στα τοιχώματα του δοχείου και η συχνότητα των συγκρούσεων, δηλαδή η πίεση.
Ο νόμος του Gay-Lussac για το ίδιο αέριο σε δύο διαφορετικές καταστάσεις δίνεται ως,
P1/P2 =T1/T2
P1.T2 =T1.P2
Εφαρμογές του νόμου του Gay-Lussac
Ο νόμος του Gay-Lussac μπορεί να φανεί σε δράση σε πολλές καθημερινές δραστηριότητες. Μερικά παραδείγματα αυτών περιλαμβάνουν τη λειτουργία χύτρας ταχύτητας, εκρήξεις ελαστικών το καλοκαίρι, σε εργαλεία πυροδότησης όπως όπλα, δοχεία αεροζόλ κ.λπ.
Οι εκρήξεις ελαστικών είναι μια συνηθισμένη εμπειρία κατά τη διάρκεια του καλοκαιριού, στην πραγματικότητα, οι εκρήξεις ελαστικών κατά τη διάρκεια του καλοκαιριού είναι τόσο συχνές που η περίοδος μεταξύ Μαΐου και Οκτωβρίου ονομάζεται περίοδος έκρηξης. Οι εκρήξεις συμβαίνουν λόγω της συσσώρευσης θερμότητας που προκαλείται από την τριβή μεταξύ των ελαστικών και του οδοστρώματος. Τα καλοκαίρια, η άσφαλτος που στρώνεται στους δρόμους είναι ήδη σε πολύ υψηλή θερμοκρασία και αυτό προσθέτει το δίλημμα.
Λόγω της τριβής, η θερμοκρασία των ελαστικών (που αποτελούνται από καουτσούκ και επομένως, ένας καλός αγωγός της θερμότητας) αυξάνεται και κατά συνέπεια αυξάνεται και η θερμοκρασία του αέρα μέσα στο ελαστικό. Μια αύξηση της θερμοκρασίας του αέρα ακολουθείται από αύξηση της πίεσης, όπως εξηγείται από το νόμο του Gay-Lussac. Η αύξηση της πίεσης συνοδεύεται επίσης από αύξηση του όγκου του αέρα. Τελικά, όπως και στα δοχεία αεροζόλ, επιτυγχάνεται ένα σημείο όπου τα ελαστικά δεν μπορούν πλέον να συγκρατήσουν τον αέρα υψηλής πίεσης και τον όγκο του διαστελλόμενου αέρα μέσα και εκρήγνυνται.
Ιστορία του νόμου του Gay-Lussac
Η σχέση μεταξύ θερμοκρασίας και πίεσης παρατηρήθηκε για πρώτη φορά από έναν Γάλλο φυσικό, τον Guillaume Amontons. Αν και τα αποτελέσματα και τα συμπεράσματα που έβγαλε ο Amontons ήταν μόνο εν μέρει σωστά. Οι μελέτες και τα πειράματά του με τον αέρα ως δείγμα αερίου τον οδήγησαν στο συμπέρασμα ότι η πίεση ενός αερίου αυξάνεται κατά περίπου το ένα τρίτο μεταξύ των θερμοκρασιών του κρύου νερού και του βραστού νερού.
Οι ανακρίβειες προκλήθηκαν λόγω έλλειψης διαθεσιμότητας ακριβών θερμομέτρων. Ο Amontons υπέθεσε επίσης ότι μια επαρκής μείωση της θερμοκρασίας θα προκαλούσε την πλήρη εξαφάνιση της πίεσης του αερίου.
Περισσότερα από 100 χρόνια αργότερα, γύρω στο 1802, ο Joseph Louis Gay-Lussac δημοσίευσε το έργο του σχετικά με τις μακρο-ιδιότητες (όγκος v, θερμοκρασία T, πίεση p, αριθμός σωματιδίων n) των αερίων. Ο Gay-Lussac σκόνταψε στον νόμο ενώ ανέπτυξε ένα θερμόμετρο αέρα.
Μαζί με τη σχέση πίεσης και θερμοκρασίας, ο Gay-Lussac δήλωσε έναν άλλο νόμο. Δήλωσε, «Σε σταθερή πίεση, ο όγκος ενός ιδανικού αερίου είναι ευθέως ανάλογος με την απόλυτη θερμοκρασία του». Αν και, αυτός ο νόμος είναι γνωστός ως νόμος του Καρόλου. καθώς ο Jacques Charles είχε καταλήξει σε ένα παρόμοιο συμπέρασμα, αλλά δεν το δημοσίευσε και ο Gay-Lussac ήταν αρκετά ταπεινός για να δώσει στον Σαρλ τα οφειλόμενα εύσημα.
Συμπέρασμα
Δεδομένου ότι η σχέση μεταξύ πίεσης και θερμοκρασίας ανακαλύφθηκε για πρώτη φορά από τον Amontons, η σχέση είναι τώρα γενικά γνωστή ως νόμος του Amontons. Ενώ το όνομα του Gay-Lussac συνδέεται με έναν άλλο νόμο που ανακάλυψε. Ο νόμος ονομάζεται νόμος του συνδυασμού αερίων και εξηγεί πώς η αναλογία των αντιδρώντων αερίων και των αέριων προϊόντων τους μπορεί να εκφραστεί χρησιμοποιώντας ακέραιους αριθμούς. Ωστόσο, ορισμένα ακαδημαϊκά βιβλία χημείας και φυσικής συνεχίζουν να προσδιορίζουν τη σχέση μεταξύ πίεσης και θερμοκρασίας ως νόμου του Gay-Lussac.




