Πώς έχει εξελιχθεί το ατομικό μοντέλο με τα χρόνια;
Από την εποχή της αρχαίας ελληνικής φιλοσοφίας έως τη σύγχρονη κβαντομηχανική, η ατομική θεωρία είχε πολλαπλές ενημερώσεις, καθεμία από τις οποίες ήταν αρκετά επαναστατική για την εποχή της.
Η κατανόησή μας για τη φύση των πραγμάτων γύρω μας είναι σε διαρκή ροή. Πράγματα που φαίνονται αρκετά προφανή τώρα μπορεί να μην υπήρχαν πριν από έναν αιώνα ή να καταστούν παρωχημένα στις επόμενες δεκαετίες. Ένα τέλειο παράδειγμα εξευγενισμού της επιστήμης με την πάροδο του χρόνου ήταν η εξέλιξη της ατομικής θεωρίας.
Ας ξεκινήσουμε από τις παλιές καλές εποχές, όταν η επιστήμη δεν βασιζόταν σε στοιχεία, αλλά έμοιαζε περισσότερο με μια μορφή φιλοσοφίας. Οι άνθρωποι πίστευαν ότι όλα αποτελούνταν μόνο από τέσσερα στοιχεία - νερό, φωτιά, γη και αέρα. Φανταστείτε πόσο εύκολη θα ήταν τότε η χημεία!
Η ιδέα του Δημόκριτου για το άτομο
Γύρω στο 400 π.Χ., ένας Έλληνας φιλόσοφος ονόματι Δημόκριτος διατύπωσε μια θεωρία ότι τα πάντα στον κόσμο ήταν φτιαγμένα από μικροσκοπικά άφθαρτα σωματίδια που ονομάζονταν «άτομος», που σημαίνει «άκοπο». Πίστευε ότι οι ιδιότητες των υλικών εξαρτώνται από τον τύπο του ατόμου από το οποίο κατασκευάζονταν. Για παράδειγμα, τα όξινα ή αιχμηρά πράγματα κατασκευάζονταν από σωματίδια με μυτερές άκρες, τα γλυκά από πιο στρογγυλεμένα και λεία άτομα, ενώ τα μέταλλα από σκληρά άτομα. Εκτός από αυτή την παρερμηνεία του σχήματος, ο Δημόκριτος ήταν λίγο πολύ στον σωστό δρόμο όσον αφορά την ατομική σύνθεση που υπαγορεύει την ιδιότητα μιας ουσίας.
Ωστόσο, αυτή η θεωρία απαξιώθηκε σε μεγάλο βαθμό από τον Αριστοτέλη, τον αρχικό κοινωνικό επιρροή, ο οποίος πίστευε ότι τα πάντα στον πλανήτη αποτελούνταν από τέσσερα στοιχεία:γη, φωτιά, νερό και αέρα.
Η ατομική θεωρία του Ντάλτον
Ο επόμενος σταθμός της συνεχώς μεταβαλλόμενης ατομικής θεωρίας ήρθε σχεδόν 2.000 χρόνια αργότερα, από έναν Βρετανό χημικό και λάτρη της μετεωρολογίας ονόματι John Dalton. Διεξήγαγε πειράματα όπου ανακάτεψε δύο αέρια και παρατήρησε τη συμπεριφορά τους. Τα περισσότερα από τα αέρια που δοκίμασε υπήρχαν ανεξάρτητα χωρίς να ενοχλούνται από την παρουσία του άλλου. Ωστόσο, βρήκε κάτι διαφορετικό όταν το μονοξείδιο του αζώτου αφέθηκε να αλληλεπιδράσει με το ατμοσφαιρικό οξυγόνο. 36 μέτρα καθαρού νιτρώδους αερίου αντέδρασαν με 100 μέτρα αέρα για να δώσουν 80 μέτρα ενός νέου αερίου που δεν ήταν ούτε νιτρώδες ούτε οξυγονούχο.
Αυτό του κέντρισε την περιέργεια, έτσι διεξήγαγε το ίδιο πείραμα με διαφορετικούς όγκους αερίου. Παρατήρησε ότι τα αέρια αντιδρούσαν μεταξύ τους μόνο σε μια σταθερή αναλογία, η οποία προκάλεσε τον νόμο των πολλαπλών αναλογιών και τη θεωρία του ατομισμού.
Ο Dalton θεώρησε ότι τα πάντα σε αυτόν τον κόσμο αποτελούνταν από άτομα - μικροσκοπικές άφθαρτες στερεές σφαίρες που ήταν μοναδικές για κάθε στοιχείο. Τα άτομα διαφορετικών στοιχείων συνδυάζονται για να σχηματίσουν διαφορετικές ενώσεις και αναδιατάχθηκαν κατά τη διάρκεια χημικών αντιδράσεων. Ακόμη και μετά από 200 χρόνια, ορισμένες από αυτές τις ιδέες παραμένουν αληθινές.
Μοντέλο πουτίγκας δαμάσκηνου Thompson
Μέχρι τα τέλη του 19ου αιώνα, τα άτομα απεικονίζονταν ως αδιαίρετα σωματίδια. το πρώτο άτομο που έσπασε αυτή την ιδέα ήταν ο Άγγλος φυσικός J.J Thompson και ο έμπιστος σωλήνας καθοδικών ακτίνων του. Μέσα σε ένα κενό γυάλινου σωλήνα, μια ορατή δέσμη σωματιδίων ή καθοδικών ακτίνων δημιουργήθηκε με την εφαρμογή υψηλής τάσης στα μεταλλικά ηλεκτρόδια. Το ρεύμα των σωματιδίων που παράγεται από το μέταλλο απομακρύνθηκε από το αρνητικό φορτίο και έτεινε προς το θετικό φορτίο.
Αφού επανέλαβε αυτό το πείραμα πολλές φορές με άλλα μέταλλα, κατέληξε στο πρώτο ατομικό μοντέλο. Το διάσημο μοντέλο της πουτίγκας δαμάσκηνου περιέγραψε ένα άτομο ως ένα σωματίδιο που αποτελείται από μια θετικά φορτισμένη μάζα (την πουτίγκα) με μικροσκοπικά αρνητικά φορτία ενσωματωμένα σε αυτήν (όπως τα δαμάσκηνα).
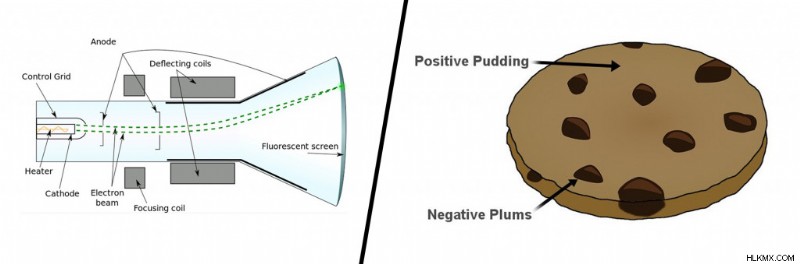
Μοντέλο καθοδικού σωλήνα και πουτίγκας δαμάσκηνου (Πιστωτική φωτογραφία :Wikimedia commons)
Πυρηνικό μοντέλο ατόμων του Rutherford
Μετά από κάποια αρχική αντίσταση, αυτό το μοντέλο έγινε αρκετά δημοφιλές στον επιστημονικό κόσμο, ωστόσο ο γεννημένος στη Νέα Ζηλανδία Ernest Rutherford δεν πείστηκε. Στις αρχές του 1900, η ραδιενέργεια ήταν σε όλη τη μανία και ο Ράδερφορντ ανακάλυψε τις ακτίνες άλφα, βήτα και γάμμα κατά τη διάρκεια της εργασίας του για τη ραδιενεργή διάσπαση. Ήθελε να αναπτύξει μια μέθοδο παραγωγής σωματιδίων άλφα και να τη χρησιμοποιήσει για να διερευνήσει τη δομή ενός ατόμου.
Έκανε ό,τι έκανε κάθε φυσικός εκείνη την εποχή — κατέληξε σε ένα πείραμα. Το πείραμα με φύλλο χρυσού, γνωστό και ως πείραμα Geiger-Marsden, αποτελούνταν από ένα λεπτό φύλλο χρυσού φύλλου με μια κυκλική οθόνη επικαλυμμένη με Θειούχο Ψευδάργυρο πίσω του που αναβοσβήνει κάθε φορά που ένα σωματίδιο άλφα το χτυπούσε. Ο Ράδερφορντ περίμενε ότι τα σωματίδια θα περνούσαν μέσα από το φύλλο και θα χτυπούσαν την οθόνη πίσω από αυτό. Ενώ τα περισσότερα από τα σωματίδια συμπεριφέρθηκαν όπως αναμενόταν, ορισμένα εκτρέπονταν σε γωνία μεγαλύτερη από 90 μοίρες.
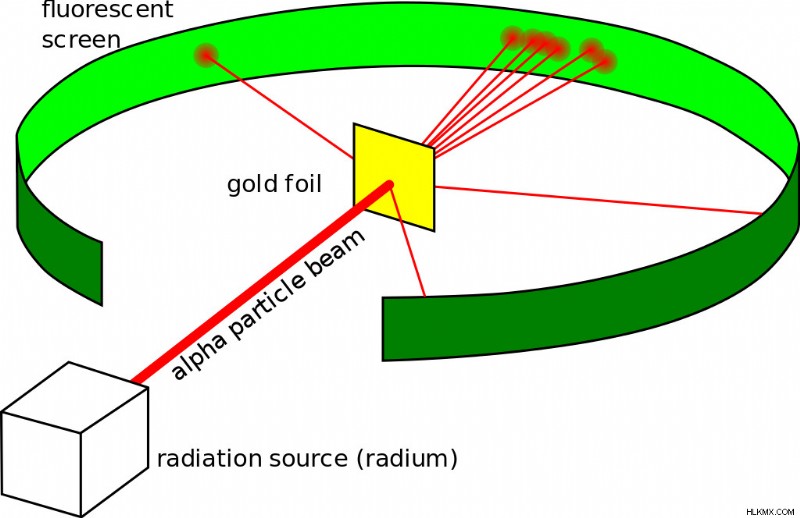
Πείραμα με χρυσό φύλλο Geiger-Marsden (Προσφορά φωτογραφίας :Kurzon/Wikimedia commons)
Υποστηριζόμενος από τις παρατηρήσεις του, κατέληξε σε ένα νέο ατομικό μοντέλο που διέψευσε το προηγούμενο. Πρότεινε μια ατομική δομή όπου το μεγαλύτερο μέρος της μάζας του ατόμου συγκεντρωνόταν σε ένα θετικά φορτισμένο κέντρο (το οποίο αργότερα ονόμασε πυρήνα, στα λατινικά «καρύδι»), γύρω από το οποίο τα ηλεκτρόνια περιφέρονταν σαν πλανήτες γύρω από τον ήλιο.
Το μοντέλο των ατόμων του Bohr
Ένα χρόνο μετά τη δημοσίευση της ατομικής θεωρίας του Rutherford, ο Niels Bohr βρήκε μια ασυμφωνία στο μοντέλο. Εάν τα ηλεκτρόνια περιφέρονταν γύρω από ένα θετικά φορτισμένο κέντρο, κάποια στιγμή, αυτά τα ηλεκτρόνια θα έχαναν την ενέργειά τους και θα κατέρρεαν στον πυρήνα, καθιστώντας τα άτομα ασταθή. Ωστόσο, αυτό δεν συνέβη, καθώς τα περισσότερα άτομα αποδείχθηκαν αρκετά σταθερά (εκτός από τα ραδιενεργά).
Εδώ εμφανίστηκε η κβαντική φυσική. Ο Bohr χρησιμοποίησε την έννοια της κβαντισμένης ενέργειας για να προτείνει ότι τα ηλεκτρόνια κινούνται γύρω από τον πυρήνα σε σταθερές τροχιές ή κελύφη. Τα κελύφη που βρίσκονται πιο κοντά στον πυρήνα έχουν χαμηλότερη ενέργεια και το πιο μακριά έχει την υψηλότερη. Εάν ένα ηλεκτρόνιο μεταπηδήσει σε τροχιά χαμηλότερης ενέργειας, εκπέμπει την επιπλέον ενέργεια με τη μορφή ακτινοβολίας, διατηρώντας έτσι την ατομική σταθερότητα.
Παρόλο που το μοντέλο του Bohr δεν ισχύει για πολύπλοκα συστήματα πολλών ηλεκτρονίων, αυτό το μοντέλο εξακολουθεί να είναι η πιο δημοφιλής αναπαράσταση της ατομικής δομής στα περισσότερα σχολικά βιβλία.

(Φωτογραφία:Kurzon/Wikimedia commons)
Ατομικό μοντέλο Schrödinger
Όσο κι αν προσπαθούμε, δεν αποφεύγουμε την πολυπλοκότητα της κβαντικής μηχανικής. Με την καθιέρωση της κβαντικής συμπεριφοράς οντοτήτων όπως τα ηλεκτρόνια, κατέστη σαφές ότι το ατομικό μοντέλο του Bohr δεν ικανοποιούσε την αρχή της αβεβαιότητας του Heisenberg. Σύμφωνα με την αρχή της αβεβαιότητας, είναι αδύνατο να γνωρίζουμε την ακριβή θέση και την τροχιά των ηλεκτρονίων σε ένα άτομο, πράγμα που σημαίνει ότι δεν μπορούν να υπάρχουν σε σταθερές τροχιές, όπως υπέθεσε ο Bohr.
Συνδυάζοντας την έννοια της δυαδικότητας κύματος-σωματιδίου και την αρχή της αβεβαιότητας, ο Erwin Schrödinger κατέληξε στο κβαντομηχανικό μοντέλο ενός ατόμου. Σε αυτό το μοντέλο, τα ηλεκτρόνια δεν περιστρέφονται γύρω από τον πυρήνα σε κυκλικές τροχιές, αλλά μάλλον ως σύννεφα ηλεκτρονίων σε ένα ατομικό τροχιακό - μια περιοχή μέσα στο άτομο όπου η πιθανότητα εύρεσης ηλεκτρονίου είναι η υψηλότερη. Διατύπωσε επίσης τις κυματικές εξισώσεις Schrödinger, οι οποίες θα μας βοηθούσαν να υπολογίσουμε με ακρίβεια την ενέργεια των επιπέδων ηλεκτρονίων σε ένα άτομο. Αυτό το νέο και βελτιωμένο ατομικό μοντέλο δεν μας λέει πού βρίσκεται ένα ηλεκτρόνιο, αλλά πού θα μπορούσε είναι.
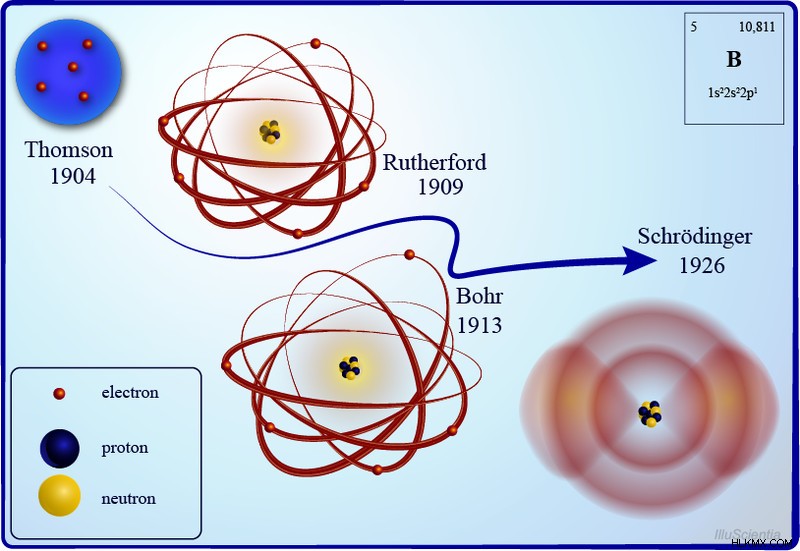
Εξέλιξη των ατομικών μοντέλων με την πάροδο των ετών (Φωτογραφία :IlluScientia/Wikimedia commons)
Η ανθρωπότητα ήταν πάντα γεμάτη με μεγάλα ερωτήματα:Τι συνθέτει τον κόσμο γύρω μας; Και γιατί διαφορετικά υλικά συμπεριφέρονται διαφορετικά;
Κάθε βήμα στην εξέλιξη της ατομικής θεωρίας μας έχει φέρει λίγο πιο κοντά στην κατανόηση των μυστικών των υποατομικών σωματιδίων που διέπουν τον ζωντανό και ζωηρό κόσμο μας. Και όμως… υπάρχουν πάντα περισσότερα να μάθετε!




