Ορισμός και παραδείγματα μιας αντίδρασης αντικατάστασης

Λάβετε τον ορισμό μιας απλής αντίδρασης αντικατάστασης ή μιας αντίδρασης μονής μετατόπισης. Λάβετε παραδείγματα αντιδράσεων μεμονωμένης αντικατάστασης και μάθετε πώς να χρησιμοποιείτε τη σειρά αντιδραστικότητας μετάλλων για να προβλέψετε εάν θα συμβεί μια αντίδραση και τα προϊόντα.
Ορισμός αντίδρασης απλής αντικατάστασης
Μια αντίδραση μίας αντικατάστασης είναι μια χημική αντίδραση όπου ένα στοιχείο αντικαθιστά ένα άλλο σε μια ένωση. Είναι επίσης γνωστή ως αντίδραση μονής μετατόπισης . Η γενική μορφή μιας απλής χημικής εξίσωσης αντίδρασης αντικατάστασης είναι:
A + BC → B + AC
Οι αντιδράσεις απλής αντικατάστασης συμβαίνουν όταν το Α είναι πιο αντιδραστικό από το Β ή το προϊόν AC είναι πιο σταθερό από το BC. Τα Α και Β μπορεί να είναι είτε δύο μέταλλα (συμπεριλαμβανομένου του υδρογόνου, το C είναι ανιόν) είτε δύο αλογόνα (το C είναι κατιόν). Εάν τα BC και AC βρίσκονται σε υδατικά διαλύματα, το C δρα ως ιόν θεατή.
Παραδείγματα αντίδρασης απλής αντικατάστασης
Υπάρχουν δύο διαφορετικά σενάρια για αντιδράσεις απλής αντικατάστασης. Σε μια μορφή αντίδρασης, το ένα κατιόν αντικαθιστά το άλλο. Στην άλλη μορφή της αντίδρασης, το ένα ανιόν αντικαθιστά το άλλο.
Παραδείγματα αντικατάστασης κατιόντων
Συνήθως το κατιόν είναι μέταλλο, αλλά δεν χρειάζεται να είναι. Ακολουθούν παραδείγματα αντιδράσεων απλής αντικατάστασης που περιλαμβάνουν τα κατιόντα:
- Zn(s) + 2 HCl(aq) → ZnCl2 (aq) + H2 (ζ)
- 2 K + 2H2 O → 2 KOH + H2 (προσέξτε πώς το ανιόν γράφεται διαφορετικά επειδή δεν γράφουμε το νερό ως HOH)
- Cu + 2 AgNO3 → 2 Ag + Cu(NO3 )2
- Ca + 2 H2 O → Ca(OH)2 + H2
Αλλά, εάν το αντιδρών σε μορφή στοιχείου δεν είναι πιο δραστικό από το άλλο κατιόν, δεν λαμβάνει χώρα καμία αντίδραση. Σε ορισμένες περιπτώσεις, ευνοείται η αντίστροφη αντίδραση, αλλά όχι η προς τα εμπρός.
Παραδείγματα αντικατάστασης ανιόντων
Αντί για αντικατάσταση κατιόντων, μια απλή αντίδραση αντικατάστασης μπορεί να περιλαμβάνει το ανιόν. Στην πράξη, τα μόνα ανιόντα που συμμετέχουν σε αντιδράσεις απλής αντικατάστασης είναι τα αλογόνα (φθόριο, χλώριο, βρώμιο, ιώδιο). Η γενική μορφή της αντίδρασης είναι:
A + BC → BA + C
Εκτός από μια απλή αντίδραση αντικατάστασης, αυτή είναι επίσης μια αντίδραση οξείδωσης-αναγωγής ή οξειδοαναγωγής. Παραδείγματα αντιδράσεων αντικατάστασης ανιόντων περιλαμβάνουν:
- Cl2 + 2 NaBr → 2 NaCl + Br2
- Br2 + 2 KI → 2 KBr + I2
Και πάλι, εάν το στοιχειακό αντιδραστήριο δεν είναι πιο δραστικό από το άλλο ανιόν, δεν θα συμβεί καμία αντίδραση. Για παράδειγμα, δεν εμφανίζεται η ακόλουθη αντίδραση:
I2 + 2 KBr → καμία αντίδραση
Πώς να προσδιορίσετε τα προϊόντα των αντιδράσεων απλής αντικατάστασης
Το προϊόν μιας μεμονωμένης αντίδρασης αντικατάστασης είναι αρκετά εύκολο να προβλεφθεί. Εάν το καθαρό στοιχείο είναι αλογόνο, παίρνει τη θέση του άλλου αλογόνου στην ένωση. Όλα τα αλογόνα έχουν την ίδια κατάσταση οξείδωσης (-1), επομένως είναι μια απλή υποκατάσταση.
Αλλά, εάν το στοιχειακό αντιδραστήριο δεν είναι αλογόνο, αντικαθιστά το κατιόν στην ένωση. Τα δύο κατιόντα δεν έχουν πάντα την ίδια κατάσταση οξείδωσης. Ίσως χρειαστεί να εξισορροπήσετε το φορτίο του κατιόντος και του ανιόντος και στη συνέχεια να εξισορροπήσετε τη χημική εξίσωση για να λάβετε αυτό που χρειάζεστε.
Για παράδειγμα, εξετάστε την αντίδραση:
Mg(s) + AlPO4 (aq) →
Το μαγνήσιο είναι πιο αντιδραστικό από το αλουμίνιο, επομένως η αντικατάσταση είναι ευνοϊκή. Ωστόσο, το κατιόν αλουμινίου έχει φορτίο +3 (εξισορροπώντας το PO4 ανιόν), ενώ το ιόν μαγνησίου (ως μέταλλο σπανίων γαιών) έχει φορτίο +2.
Αρχικά, βρείτε τον τύπο του προϊόντος εξισορροπώντας τα φορτία κατιόντων και ανιόντων για να λάβετε:
Mg(s) + AlPO4 (aq) → Al(s) + Mg3 (PO4 )2 (aq)
Στη συνέχεια, προσαρμόστε τους συντελεστές μπροστά από τα αντιδρώντα και τα προϊόντα για να εξισορροπήσετε τη χημική εξίσωση:
3 Mg(s) + 2 AlPO4 (aq) → 2 Al(s) + Mg3 (PO4 )2 (aq)
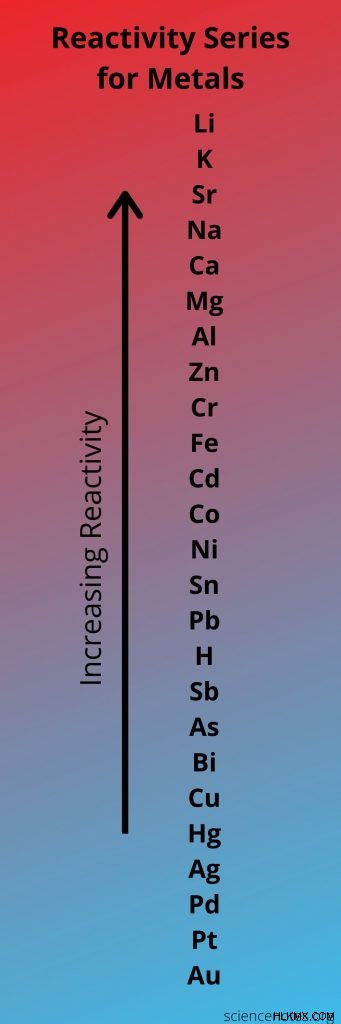
Χρήση της σειράς αντιδραστικότητας για την πρόβλεψη εάν θα προκύψει αντίδραση
Χρησιμοποιήστε τη σειρά αντιδραστικότητας για να προσδιορίσετε εάν θα προκύψει μία αντίδραση αντικατάστασης.
Για την αντικατάσταση ανιόντων, η σειρά αντιδραστικότητας για τα αλογόνα είναι:
Πιο αντιδραστικό F2> Cl2> Br2> I2 Λιγότερο αντιδραστικό
Αυτή είναι η σειρά των αλογόνων που κατεβαίνουν την ομάδα τους στον περιοδικό πίνακα, επομένως είναι εύκολο να το θυμάστε. Όσο υψηλότερο είναι το αλογόνο στον περιοδικό πίνακα, τόσο πιο αντιδραστικό είναι. Λοιπόν, Cl2 αντικαθιστά το I2 σε μία αντίδραση αντικατάστασης, αλλά δεν θα αντιδράσει εάν το ανιόν έχει ιόντα φθορίου.
Η σειρά αντιδραστικότητας για τα κατιόντα είναι μεγαλύτερη και όχι τόσο εμφανής. Τα λιγότερο δραστικά μέταλλα δεν αντιδρούν με το ιόν H(aq), ενώ τα πιο δραστικά μέταλλα όχι μόνο αντιδρούν με το ιόν, αλλά μπορούν ακόμη και να τραβήξουν το ιόν υδρογόνου από το υγρό νερό. Τα ενδιάμεσα στοιχεία μπορούν να αντιδράσουν με το ιόν H(aq) και μερικές φορές να τραβήξουν το υδρογόνο από τους υδρατμούς.
Αλλά, για ένα γενικό μάθημα χημείας, πρέπει κυρίως να γνωρίζετε ποια μέταλλα μπορούν να αντικαταστήσουν το ένα το άλλο και ποια όχι. Για παράδειγμα, ο ψευδάργυρος (Zn) μπορεί να αντικαταστήσει τον κασσίτερο (Sn) ως κατιόν σε μια ένωση, αλλά δεν μπορεί να αντικαταστήσει το κάλιο (Κ). Γενικά, τα μέταλλα των αλκαλίων είναι τα πιο δραστικά και ακολουθούν τα μέταλλα των αλκαλικών γαιών. Τα ευγενή μέταλλα, αντίθετα, είναι σχετικά μη αντιδραστικά.
Αναφορές
- Barke, Hans-Dieter; Hazari, Al; Yitbarek, Sileshi (2008). Παρανόηση στη Χημεία που αντιμετωπίζει τις αντιλήψεις στη Χημική Εκπαίδευση . Βερολίνο:Springer. ISBN 3540709894.
- Brown, Theodore; et al. (2017) Chemistry:The Central Science (14η έκδ.). Pearson. ISBN 9780134414232
- Myers, Richard (2009). Τα Βασικά της Χημείας . Greenwood Publishing Group. ISBN 978-0-313-31664-7.




