Τι είναι ο τυφλοπόντικας στη χημεία; Ορισμός 2

Στη χημεία, τυφλοπόντικας είναι μια μονάδα βάσης SI για την ποσότητα. Παρά το όνομα, δεν έχει καμία σχέση με το μικρό καφέ/γκρίζο παράσιτο του κήπου ή τη νόστιμη σάλτσα σοκολάτας στο μεξικάνικο φαγητό. Η μονάδα mole περιγράφει την ποσότητα ή τον αριθμό των πραγμάτων.
Ορισμός Mole και μονάδες
Σύμφωνα με τον ορισμό του 2019, ο τυφλοπόντικας είναι ακριβώς 6,022×10.
1 mole =6,022 x 10.
Αυτός ο αριθμός είναι ο αριθμός του Avogadro. Ο τυφλοπόντικας δεν έχει μονάδες. Απλώς περιγράφει τον αριθμό κάποιου πράγματος.
1 mole ατόμων =6,022 x 10 άτομα
1 mole νερού =6.022 x 10 μόρια νερού
1 mole κρεατοελιές =6.022 x 10 moles.
Σκοπός του τυφλοπόντικα
Ο σκοπός του κρεατοελιά είναι να κάνει τους πολύ μεγάλους αριθμούς ευκολότερους. Εξάλλου, είναι πολύ πιο εύκολο να γράψετε 1 mole από 6,022 x 10. Η μονάδα mole είναι ένα βολικό μέσο για τη μετατροπή μεταξύ ατόμων και μορίων και της μάζας αυτών των ατόμων ή μορίων. Οι τυφλοπόντικες είναι αρκετά σημαντικοί για τους χημικούς ώστε να γιορτάζουν την Ημέρα του Τυφλοπόντικα στις 23 Οκτωβρίου (10-23).
Παράδειγμα υπολογισμών Mole
Ακολουθούν μερικά παραδείγματα προβλημάτων χημείας που χρησιμοποιούν το mole:
Παράδειγμα Mole Πρόβλημα #1
Βρείτε τη μάζα ενός ατόμου.
Ερώτηση: Ποια είναι η μάζα ενός μόνο ατόμου αζώτου;
Λύση: Η ατομική μάζα ενός στοιχείου είναι η μάζα σε γραμμάρια ενός mole αυτού του στοιχείου. Όταν κοιτάμε τον περιοδικό πίνακα, βλέπουμε ότι η ατομική μάζα του αζώτου είναι 14.001 γραμμάρια/γραμμομόριο.
Αυτό σημαίνει ότι 1 mole ατόμων αζώτου έχει μάζα 14.001 γραμμάρια.
1 mole ατόμων N =6,022 x 10 N ατόμων =14,001 γραμμάρια.
Διαιρέστε και τις δύο πλευρές της εξίσωσης με 6,022 x 10 άτομα N για να λάβετε τη μάζα ενός ατόμου αζώτου.

1 άτομο N =2,325 x 10 g.
Απάντηση: Ένα άτομο αζώτου έχει μάζα 2,325 x 10 γραμμάρια.
Παράδειγμα Mole Πρόβλημα #2
Βρείτε τη μάζα ενός γνωστού αριθμού μορίων.
Ερώτηση: Ποια είναι η μάζα σε γραμμάρια 5 δισεκατομμυρίων μορίων νερού;
Λύση:
Βήμα 1: Βρείτε τη μάζα ενός mol νερού.
Το νερό είναι H2 Ο. Επομένως, για να βρούμε τη μάζα ενός mole νερού, πρέπει να γνωρίζουμε τη μάζα του υδρογόνου και τη μάζα του οξυγόνου.
Στον περιοδικό μας πίνακα βλέπουμε ότι η μάζα ενός mol υδρογόνου είναι 1,001 g και η μάζα ενός mole οξυγόνου είναι 16,00 g.
Ένα mole νερού έχει 2 mole υδρογόνου και 1 mole οξυγόνου.
Μάζα ενός mole νερού =2 (μάζα υδρογόνου) + 1 μάζα οξυγόνου
Μάζα ενός mole νερού =2 (1,001 g) + 16,00 g =18,002 g

Βήμα 2: Βρείτε τη μάζα 5 δισεκατομμυρίων (5 x 10) μορίων νερού.
Για αυτό το μέρος, χρησιμοποιούμε τον αριθμό του Avogadro σε αναλογία. Επίλυση για x γραμμάρια
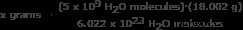
x γραμμάρια =1,49 x 10 γραμμάρια
Απάντηση: 5 δισεκατομμύρια μόρια νερού έχουν μάζα 1,49 x 10 γραμμάρια.
Παράδειγμα προβλήματος #3
Βρείτε τον αριθμό των μορίων σε μια δεδομένη μάζα.
Ερώτηση :Πόσα μόρια νερού σε 15 γραμμάρια πάγου;
Λύση:
Βήμα 1: Βρείτε τη μάζα ενός mol νερού.
Κάναμε αυτό το βήμα στο δεύτερο παράδειγμα. Ένα mole νερού είναι 18.002 γραμμάρια.

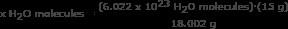
Βήμα 2: Χρησιμοποιήστε τον αριθμό του Avogadro σε μια αναλογία. Λύστε για x H2 O μόρια
x H2 Μόρια Ο =5,018 x 10 H2 O μόρια
Απάντηση: Υπάρχουν 5,018 x 10 μόρια νερού σε 15 γραμμάρια πάγου.
Αναφορές
- Ανδρέας, Μπιρκ; et al. (2011). «Προσδιορισμός της σταθεράς Avogadro με την καταμέτρηση των ατόμων σε ένα κρύσταλλο 28Si». Επιστολές φυσικής ανασκόπησης . 106 (3):30801. doi:10.1103/PhysRevLett.106.030801
- Bureau International des Poids et Mesures (2019). Το Διεθνές Σύστημα Μονάδων (SI) (9η έκδ.).
- de Bièvre, Paul; Peiser, Η. Steffen (1992). ""Ατομικό βάρος" - Το όνομα, η ιστορία, ο ορισμός και οι μονάδες του". Καθαρή και Εφαρμοσμένη Χημεία . 64 (10):1535–43. doi:10.1351/pac199264101535
- Himmelblau, David (1996). Βασικές Αρχές και Υπολογισμοί στη Χημική Μηχανική (6 εκδ.). ISBN 978-0-13-305798-0.
- Yunus A. Çengel; Boles, Michael A. (2002). Θερμοδυναμική:Μια Μηχανική Προσέγγιση (8η έκδ.). TN:McGraw Hill. ISBN 9780073398174.