Παράδειγμα νόμου περί ιδανικού αερίου – Άγνωστο πρόβλημα αερίου

Ο νόμος του ιδανικού αερίου μπορεί να χρησιμοποιηθεί για τον προσδιορισμό της ταυτότητας ενός άγνωστου αερίου. Εάν σας δοθεί η πίεση, ο όγκος και η θερμοκρασία του άγνωστου αερίου, μπορείτε να προσδιορίσετε από τι είναι πιθανό να αποτελείται το αέριο. Αυτό το πρόβλημα παραδείγματος νόμου του ιδανικού αερίου δείχνει τα βήματα που είναι απαραίτητα για την ολοκλήρωση αυτής της εργασίας.
Πρόβλημα νόμου για τα αέρια
Ένα δείγμα 276,58 g του X2 (ζ) έχει όγκο 30,0 L στις 3,2 atm και 27°C. Τι είναι το στοιχείο X;
Λύση
Ο νόμος του ιδανικού αερίου εκφράζεται με τον τύπο
PV =nRT
όπου
P =Πίεση
V =Όγκος
n =αριθμός γραμμομορίων σωματιδίων αερίου
T =Απόλυτη θερμοκρασία σε Kelvin
και
R είναι η σταθερά αερίου.
Η σταθερά αερίου, R, ενώ είναι σταθερή, εξαρτάται από τις μονάδες που χρησιμοποιούνται για τη μέτρηση της πίεσης και του όγκου. Ακολουθούν μερικές τιμές του R ανάλογα με τις μονάδες.
R =0,0821 λίτρα·atm/mol·K
R =8,3145 J/mol·K
R =8,2057 m·atm/mol·K
R =62,3637 L·Torr/mol·K ή L·mmHg/mol·K
Το πρώτο βήμα για κάθε πρόβλημα νόμου του ιδανικού αερίου είναι να βεβαιωθείτε ότι η θερμοκρασία σας είναι στην απόλυτη κλίμακα θερμοκρασίας. Αυτή είναι μια συνηθισμένη πηγή λάθους για πολλούς μαθητές και είναι καλύτερο να το απομακρύνετε αμέσως μόλις ξεκινήσετε.
Το παράδειγμά μας έχει θερμοκρασία 27°C. Για να το μετατρέψετε σε Kelvin, χρησιμοποιήστε τον τύπο
K =°C + 273
K =27°C + 273
K =300 K
Τώρα ας επιλέξουμε την τιμή της σταθεράς αερίου που είναι κατάλληλη για το παράδειγμά μας. Το παράδειγμα χρησιμοποιεί λίτρα και ατμόσφαιρες, επομένως η τιμή του R που πρέπει να χρησιμοποιήσουμε είναι
R =0,0821 liter·atm/mol·K
Τώρα έχουμε ό,τι χρειαζόμαστε για να χρησιμοποιήσουμε τον νόμο του ιδανικού αερίου για να βρούμε τον αριθμό των mol του δείγματος αερίου μας. Η επίλυση της εξίσωσης για n αποδόσεις
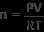
Συνδέστε τις αξίες μας

n =3,9 moles
Τώρα γνωρίζουμε ότι υπάρχουν 3,9 mol του άγνωστου αερίου στο σύστημα. Γνωρίζουμε επίσης ότι αυτοί οι 3,9 κρεατοελιές έχουν μάζα 276,58 γραμμάρια. Τώρα βρείτε πόσο ζυγίζει ένα mole του αερίου.
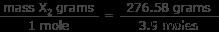
μοριακή μάζα X2 =70,9 γραμμάρια/mol
X2 σημαίνει ότι το αέριό μας είναι διατομικό ή αποτελείται από δύο άτομα του στοιχείου Χ. Αυτό σημαίνει ότι το ατομικό βάρος του Χ θα είναι το μισό της τιμής του X2 's μοριακή μάζα.
ατομικό βάρος X =½ (70,9 γραμμάρια/mol)
ατομικό βάρος Χ =35,45 γραμμάρια/γραμμομόριο
Κοιτάζοντας σε έναν περιοδικό πίνακα, το στοιχείο με ατομικό βάρος πλησιέστερο στα 35,45 γραμμάρια/mol είναι το χλώριο.
Απάντηση
Η ταυτότητα του στοιχείου Χ είναι το χλώριο.
Τα βασικά σημεία που πρέπει να προσέξετε με αυτό το είδος προβλήματος είναι η απόλυτη θερμοκρασία, οι μονάδες της σταθεράς του αερίου R και η ατομική μάζα ενός ατόμου του άγνωστου αερίου. Τα προβλήματα του νόμου του ιδανικού αερίου θα πρέπει πάντα να λειτουργούν με θερμοκρασίες απόλυτης κλίμακας, όχι με σχετικές θερμοκρασίες όπως ο Κελσίου ή το Φαρενάιτ. Οι μονάδες στη σταθερά αερίου πρέπει να ταιριάζουν με τις μονάδες με τις οποίες εργάζεστε, διαφορετικά δεν θα ακυρωθούν. Αυτό είναι ένα εύκολο σφάλμα που πρέπει να αποφευχθεί αν δώσετε προσοχή. Αυτό το πρόβλημα είχε ως άγνωστο ένα διατομικό αέριο. Αν δεν θυμόμασταν αυτό το βήμα, θα νομίζαμε ότι ένα mole του αερίου είχε μάζα 70,9 γραμμαρίων και θα αποφασίσαμε ότι το αέριό μας ήταν γάλλιο (69,72 g/mol).




