Στοιχεία για το μαγνήσιο 1
Το μαγνήσιο είναι το δωδέκατο στοιχείο του περιοδικού πίνακα. Αυτά τα στοιχεία μαγνησίου περιέχουν χημικά και φυσικά δεδομένα μαζί με γενικές πληροφορίες και ιστορικό.

Βασικά στοιχεία για το μαγνήσιο
Όνομα: Μαγνήσιο
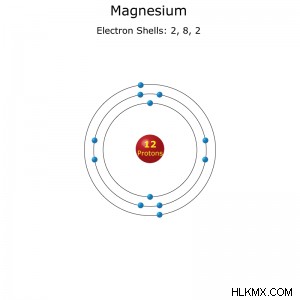
Ατομικός αριθμός: 12
Σύμβολο στοιχείου: Mg
Ομάδα: 2
Περίοδος: 3
Αποκλεισμός: s
Οικογένεια στοιχείων: αλκαλική γη
Ατομική μάζα: [24.304, 24.307]
Οδηγίες IUPAC για να αντικατοπτρίζει το φυσικό και χημικό ιστορικό του δείγματος μαγνησίου. Εάν απαιτείται μία μόνο τιμή της ατομικής μάζας, χρησιμοποιήστε 24.305.
Διαμόρφωση ηλεκτρονίου: [Ne]3s (συντομογραφία) ή 1s2s2p3 (πλήρη)
Ανακάλυψη: Ο Joseph Black το 1755 προσδιόρισε το μαγνήσιο ως στοιχείο. Ο Sir Humphrey Davy απομόνωσε καθαρό μαγνήσιο το 1808.
Πολλοί χημικοί πίστευαν ότι ο ασβέστης (οξείδιο του ασβεστίου) και η μαγνησία (οξείδιο του μαγνησίου) ήταν η ίδια ουσία. Και τα δύο παράγονταν με θέρμανση ασβεστόλιθου και μαγνησίτη. Το μαύρο έδειξε ότι το καθένα είχε διαφορετικές χημικές ιδιότητες. Η Μαγνησία περιείχε ένα άγνωστο στοιχείο παρόμοιο με το ασβέστιο. Λίγο περισσότερο από 50 χρόνια αργότερα, ο Davy διαχώρισε το μαγνήσιο από ένα κράμα μαγνησίας και υδραργύρου χρησιμοποιώντας ηλεκτρόλυση.
Προέλευση ονόματος: Ο Davy ονόμασε το στοιχείο από το αρχικό του υλικό, τη μαγνησία.
Ισότοπα:
Το φυσικό μαγνήσιο αποτελείται από τρία σταθερά ισότοπα:Mg, Mg και Mg. Δεκαεννέα ραδιενεργά ισότοπα έχουν παραχθεί σε εργαστηριακές συνθήκες που κυμαίνονται από Mg έως Mg.
Mg
Το μαγνήσιο-24 είναι ένα σταθερό ισότοπο που περιέχει 12 νετρόνια. Το 78,99% του φυσικού μαγνησίου είναι μαγνήσιο-24.
Mg
Το μαγνήσιο-25 είναι ένα σταθερό ισότοπο που περιέχει 13 νετρόνια. Το 10% του φυσικού μαγνησίου είναι μαγνήσιο-25.
Mg
Το μαγνήσιο-26 είναι ένα σταθερό ισότοπο που περιέχει 14 νετρόνια. Το 11,01% του φυσικού μαγνησίου είναι μαγνήσιο-26.

Φυσικά δεδομένα
Πυκνότητα: 1,74 g/cm
Σημείο τήξης: 923 K(650 °C, 1202 °F)
Σημείο βρασμού: 1363 K(1091 °C, 1994 °F)
Κατάσταση στους 20ºC: Στερεά
Heat of Fusion: 8,48 kJ/mol
Θερμότητα εξάτμισης: 128 kJ/mol
Μοριακή θερμική χωρητικότητα: 24.869 J/mol·K
Ατομικά δεδομένα
Ατομική ακτίνα: 1,6 Å
Ομοιοπολική ακτίνα: 1,41 Å
Ακτίνα Van der Waals: 1,73 Å
Συγγένεια ηλεκτρονίων: μη σταθερό
Ηλεκτραρνητικότητα: 1.31
1 Ενέργεια Ιονισμού: 737,75 kJ/mol
2 Ενέργεια Ιονισμού: 1450,683 kJ/mol
3 Ενέργεια Ιονισμού: 7732.692 kJ/mol
4 Ενέργεια Ιονισμού: 10542,519 kJ/mol
5 Ενέργεια Ιονισμού: 13630,48 kJ/mol
6 Ενέργεια Ιονισμού: 18019,6 kJ/mol
7 Ενέργεια Ιονισμού: 21711,13 kJ/mol
8 Ενέργεια Ιονισμού: 25661,24 kJ/mol
Καταστάσεις οξείδωσης: +2 (κοινό), +1 (ασυνήθιστο)
Διασκεδαστικά στοιχεία για το μαγνήσιο
- Το μαγνήσιο είναι ένα ασημί-λευκό αλκαλικό στερεό σε θερμοκρασία δωματίου.
- Το μαγνήσιο έχει ξινή γεύση. Μικρές ποσότητες μαγνησίου στο μεταλλικό νερό του δίνουν αυτή την ελαφρώς ξινή γεύση.
- Το πρώιμο όνομα για το μαγνήσιο ήταν "μαγνήσιο". Η μεταλλική μορφή του μαγγανίου ήταν ήδη γνωστή ως μαγνήσιο. Ο Davy πείστηκε από τους συναδέλφους του να αλλάξει το όνομα σε μαγνήσιο και το μέταλλο μαγγάνιο μόλις ονομάστηκε μαγγάνιο.
- Το μαγνήσιο είναι ένα κεντρικό άτομο στο μόριο της χλωροφύλλης. Αποτελεί ουσιαστικό μέρος της διαδικασίας της φωτοσύνθεσης.
- Το μαγνήσιο είναι το ένατο πιο άφθονο στοιχείο στο σύμπαν.
- Το μαγνήσιο είναι το όγδοο πιο άφθονο στοιχείο στον φλοιό της Γης.
- Το μαγνήσιο είναι το 11ο πιο άφθονο στοιχείο στο ανθρώπινο σώμα. Υπάρχει μαγνήσιο σε κάθε ένα από τα κύτταρά σας.
- 60% του μαγνησίου που βρίσκεται στο σώμα σας βρίσκεται στο σκελετικό σας σύστημα.
- Το μαγνήσιο καίγεται πολύ έντονα και χρησιμοποιείται σε πυροτεχνήματα για να κάνει λευκές λάμψεις.
- Το μαγνήσιο προστίθεται στα κράματα για τη μείωση του βάρους των υλικών αλουμινίου.
- Το μαγνήσιο βρίσκεται σε ορισμένους πυροσβέστες για να παράγει σπινθήρες όταν τρίβεται με χάλυβα.
- Το υδροξείδιο του μαγνησίου προστίθεται σε ορισμένα πλαστικά για να τα κάνει ανθεκτικά στη φωτιά.
- Μια κατηγορία οργανικών ενώσεων μαγνησίου γνωστά ως αντιδραστήρια Grignard είναι σημαντικές ενώσεις στις αντιδράσεις σύνθεσης στην οργανική χημεία. Αυτές οι ενώσεις έχουν τη μορφή:RMg-X, όπου το R είναι μια λειτουργική ομάδα άνθρακα και το X είναι ένα αλογονίδιο.
Μάθετε περισσότερα σχετικά με τα στοιχεία στον περιοδικό πίνακα.




