Γεγονότα άνθρακα – Ατομικός αριθμός 6 – Σύμβολο στοιχείου C 2
Ο άνθρακας είναι το έκτο στοιχείο του περιοδικού πίνακα. Αυτά τα στοιχεία άνθρακα περιέχουν χημικά και φυσικά δεδομένα μαζί με γενικές πληροφορίες και ιστορικό.
Διασκεδαστικά στοιχεία για τον άνθρακα
- Το αλλοτρόπο γραφίτη του άνθρακα είναι ένα από τα πιο μαλακά υλικά όπου τα διαμάντια είναι ένα από τα πιο σκληρά.
- Ο γραφίτης είναι γυαλιστερός και μαύρος, τα διαμάντια είναι άχρωμα διαφανή στερεά και τα φουλερένια και ο άμορφος άνθρακας είναι και οι δύο μαύρες σκόνες που μοιάζουν με αιθάλη.
- Τα άτομα άνθρακα μπορούν να σχηματίσουν αλυσίδες και δακτυλίους και να σφραγιστούν με άτομα υδρογόνου για να σχηματίσουν ενώσεις που ονομάζονται υδρογονάνθρακες. Αυτές οι ενώσεις αποτελούν ένα πολύ μεγάλο μέρος της οργανικής χημείας.
- Ο άνθρακας είναι ένα αμέταλλο που μπορεί να σχηματίσει περισσότερες από 10 εκατομμύρια διαφορετικές ενώσεις.
- Ο άνθρακας έχει το υψηλότερο σημείο εξάχνωσης από όλα τα στοιχεία. Τα διαμάντια λιώνουν περίπου στους 3550 ºC και άλλα αλλότροπα υψηλά στους 3800ºC περίπου.
- Ο καθαρός άνθρακας είναι ένα από τα λίγα στοιχεία που υπάρχουν ελεύθεροι στη φύση.
- Ο άνθρακας είναι το τέταρτο πιο άφθονο στοιχείο στο σύμπαν κατά μάζα.
- Το 18% του σωματικού σας βάρους είναι άνθρακας.
- Ο γραφίτης χρησιμοποιείται ως θερμομονωτικό. Είναι επίσης καλός αγωγός του ηλεκτρισμού.
- Ο άνθρακας-14 χρησιμοποιείται για τη χρονολόγηση κάποτε ζωντανής ύλης σε μια διαδικασία γνωστή ως Χρονολόγηση άνθρακα.

Κύτταρο Περιοδικού Πίνακα Άνθρακα
Βασικά στοιχεία για τον άνθρακα
Όνομα: Άνθρακα
Ατομικός αριθμός: 6
Σύμβολο στοιχείου: Γ
Ομάδα: 14
Περίοδος: 2
Αποκλεισμός: p
Οικογένεια στοιχείων: μη μέταλλο
Ατομική μάζα: [12.0096; 12.0116] Οδηγίες IUPAC. Για μεμονωμένη τιμή, χρησιμοποιήστε 12.011.
Διαμόρφωση ηλεκτρονίου: [He]2s2p(συντομογραφία) ή 1s2s2p(πλήρη)
Ανακάλυψη: Ο άνθρακας είναι γνωστός από τους προϊστορικούς χρόνους.
Προέλευση ονόματος: Το όνομα άνθρακας προέρχεται από τη λατινική λέξη carbo , που σημαίνει κάρβουνο.
Κοινά αλλότροπα: άμορφο, διαμάντι, φουλερένιο, γραφένιο, γραφίτης
Φυσικά ισότοπα:
Το φυσικό βόριο αποτελείται από δύο σταθερά ισότοπα και ένα ραδιενεργό ισότοπο.
Το C
Carbon-12 είναι ένα σταθερό ισότοπο που περιέχει 6 νετρόνια. Περίπου το 99% του συνόλου του φυσικού άνθρακα είναι άνθρακας-12.
Το C
Ο άνθρακας-13 είναι ένα σταθερό ισότοπο που περιέχει 7 νετρόνια. Το μεγαλύτερο μέρος του υπόλοιπου φυσικού άνθρακα είναι άνθρακας-13.
Το C
Ο άνθρακας-13 είναι ένα ραδιενεργό ισότοπο που περιέχει 8 νετρόνια. Ο άνθρακας-14 εμφανίζεται φυσικά σε ίχνη. Διασπάται κατά β- διασπάται σε Β με χρόνο ημιζωής 5730 χρόνια.
Υπάρχουν 12 γνωστά τεχνητά ραδιοϊσότοπα που κυμαίνονται από άνθρακα-8 έως άνθρακα-22.

Γραφίτης άνθρακα (USGS)
Φυσικά δεδομένα
Πυκνότητα:
Γραφίτης:2,2 g/cmΔιαμάντι:3,513 g/cm
Σημείο εξάχνωσης: 3915 K(3642 °C, 6588 °F)
Τριπλό σημείο: 4600 K στα 10800 kPa
Κατάσταση στους 20ºC: Στερεά
Heat of Fusion: Γραφίτης: 117 kJ/mol
Μοριακή θερμική χωρητικότητα:
Γραφίτης:8,517 J/mol·K
Διαμάντι: 6,155 J/mol·K
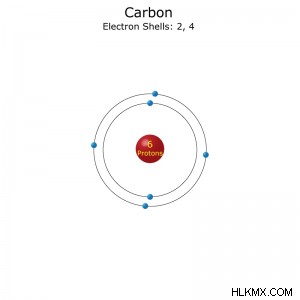
Διαμόρφωση ηλεκτρονίων ενός ατόμου άνθρακα.
Ατομικά δεδομένα
Ατομική ακτίνα: 1,70 Å
Ομοιοπολική ακτίνα: sp:0,77 Å
sp:0,73 Å
sp:0,69 Å
Ακτίνα Van der Waals: 1,70 Å
Συγγένεια ηλεκτρονίων: 121,776 kJ/mol
Ηλεκτραρνητικότητα: (Κλίμακα Pauling): 2,55
1 Ενέργεια ιονισμού: 1086,454 kJ/mol
2 Ενέργεια ιονισμού: 2352.631 kJ/mol
3 Ενέργεια ιονισμού: 4620,471 kJ/mol
4 Ενέργεια ιονισμού: 6222,716 kJ/mol
5 Ενέργεια ιονισμού: 37830,648 kJ/mol
6 Ενέργεια ιονισμού: 47277,174 kJ/mol
Συνήθεις καταστάσεις οξείδωσης: +4, -4 (κοινό), +3, +2, +1, 0, -1, -2, -3 (ασυνήθιστο)
Μάθετε περισσότερα σχετικά με τα στοιχεία στον περιοδικό πίνακα.