Είναι η αμμωνία οξύ ή βάση;
Η αμμωνία είναι αδύναμη βάση επειδή το άτομο αζώτου της έχει ένα ζεύγος ηλεκτρονίων που δέχεται εύκολα ένα πρωτόνιο. Επίσης, όταν διαλύεται στο νερό, η αμμωνία αποκτά ιόντα υδρογόνου από το νερό για να παράγει υδροξείδιο και ιόντα αμμωνίου. Η παραγωγή αυτών των ιόντων υδροξειδίου είναι που προσδίδει στην αμμωνία τη χαρακτηριστική βασικότητά της.
Υπάρχουν μερικές χημικές ενώσεις που είναι ιδιαίτερα γνωστές για το πόσο εντυπωσιακά δύσοσμες είναι. Θυμάμαι, στο γυμνάσιο, όταν περνούσαμε από το εργαστήριο Χημείας, που μερικές φορές νιώθαμε μια έντονη μυρωδιά «σάπιου αυγού». «Πρέπει να δουλεύουν με υδρόθειο», λέγαμε. Μια άλλη ένωση που αναγνωρίσαμε αμέσως ήταν η αμμωνία. Η έντονη, διεισδυτική μυρωδιά του συνδέεται συχνά με τα ούρα, τα προϊόντα καθαρισμού και τον ανθρώπινο ιδρώτα.
Σε αυτό το άρθρο, θα συζητήσουμε την αμμωνία, τις ιδιότητές της και εάν είναι οξύ ή βάση.
Λοιπόν, ας το πάρουμε από την κορυφή…
Τι είναι η αμμωνία;
Η αμμωνία είναι μια χημική ένωση που περιέχει ένα άζωτο και τρία άτομα υδρογόνου. Γνωστό και ως azane (το όνομά του IUPAC), ο χημικός τύπος του είναι NH3.
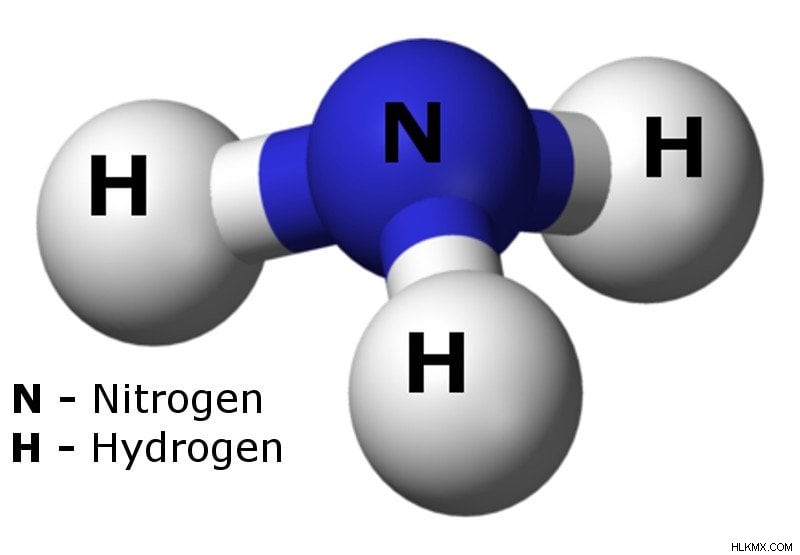
Μοντέλο αμμωνίας με μπίλια και ραβδί (Πιστωτική φωτογραφία :Ben Mills / Wikimedia Commons)
Είναι εύκολα αναγνωρίσιμο, χάρη στην έντονη, πικάντικη μυρωδιά του, η οποία μοιάζει με τα ούρα, τα προϊόντα καθαρισμού (καθώς πολλά τέτοια προϊόντα περιέχουν αμμωνία σε πολύ μικρές ποσότητες) ή μερικές φορές τον ανθρώπινο ιδρώτα.
Ωστόσο, η διεισδυτική του οσμή μπορεί να αφαιρεθεί αντιδρώντας είτε με οξικό οξύ είτε με όξινο ανθρακικό νάτριο, καθώς και οι δύο αυτές αντιδράσεις οδηγούν στην παραγωγή άοσμων αλάτων αμμωνίου.
Ιδιότητες αμμωνίας
Η αμμωνία είναι ένα άχρωμο αέριο που βρίσκεται σε πολύ μικρές ποσότητες στη φύση. Η πυκνότητά του είναι 0,589 φορές μεγαλύτερη από αυτή του αέρα, πράγμα που σημαίνει ότι είναι ελαφρύτερο από τον αέρα. Είναι πολύ διαλυτό στο νερό και ως εκ τούτου χρησιμοποιείται συνήθως ως υδατικό διάλυμα που ονομάζεται «υδατική αμμωνία». Η αμμωνία παράγεται από αζωτούχα φυτικά και ζωικά υλικά και βρίσκεται επίσης σε ίχνη στο νερό της βροχής.
Η αμμωνία εμφανίζεται επίσης στις ατμόσφαιρες αέριων πλανητών, όπως ο Δίας (0,026%) και ο Κρόνος (0,012%).

Τα ανώτερα νέφη αμμωνίας που είναι ορατά στην επιφάνεια του Δία είναι διατεταγμένα σε ζώνες που είναι παράλληλες με τον ισημερινό. (Φωτογραφία:ESA/Hubble / Wikimedia Commons)
Τι είναι η αδύναμη βάση;
Μια ασθενής βάση είναι μια χημική ένωση που διασπάται μόνο εν μέρει σε ένα υδατικό διάλυμα (ένα διάλυμα όπου ο διαλύτης είναι νερό). Ένας άλλος τρόπος να το πούμε αυτό είναι ότι μια ασθενής βάση δεν ιονίζεται πλήρως σε ένα υδατικό διάλυμα. Για τους μη μυημένους, ο ιονισμός είναι η διαδικασία μέσω της οποίας ένα άτομο ή μόριο κερδίζει/χάνει ηλεκτρόνια για να σχηματίσει ιόντα και αποκτά αρνητικό/θετικό φορτίο.
Εάν θέλετε έναν πιο τεχνικό ορισμό της αδύναμης βάσης, είναι μια βάση της οποίας η πρωτονίωση είναι ατελής. Μερικά παραδείγματα αδύναμων βάσεων είναι η μεθυλαμίνη, η αλανίνη και, φυσικά, η αμμωνία.
(Φωτογραφία:Nothingserious &Abbey311 / Wikimedia Commons)
Τι κάνει την αμμωνία αδύναμη βάση;
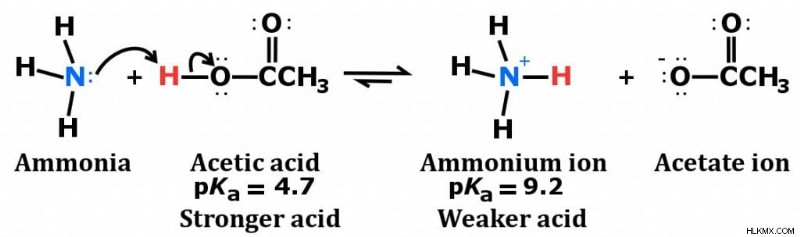
Η αμμωνία θεωρείται αδύναμη βάση ως αποτέλεσμα της χημικής της δομής, η οποία φαίνεται παρακάτω.
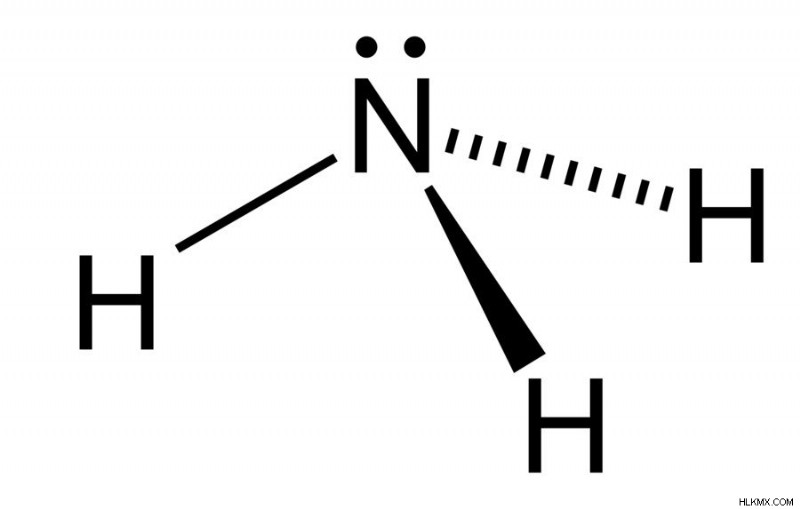
Παρατηρήστε το μοναχικό ζεύγος στο άτομο αζώτου (Προσφορά φωτογραφίας :Ben Mills / Wikimedia Commons)
Παρατηρήστε τη διαμόρφωση των ηλεκτρονίων στο άτομο του αζώτου. Αποτελείται από ένα μεμονωμένο ζεύγος (ηλεκτρόνια που δεν εμπλέκονται άμεσα στη σύνδεση), τα οποία δέχονται εύκολα ένα πρωτόνιο, αντί να δωρίζουν ένα, το οποίο οδηγεί στον σχηματισμό του ιόντος αμμωνίου.
Επίσης, όπως αναφέρθηκε προηγουμένως, η αμμωνία είναι εξαιρετικά διαλυτή στο νερό, χάρη στην πολικότητα του μορίου NH3 και την ικανότητά του να σχηματίζει δεσμούς υδρογόνου. Όταν διαλύεται στο νερό, η αμμωνία αποκτά ιόντα υδρογόνου από το νερό για να παράγει υδροξείδιο και ιόντα αμμωνίου.

Είναι η παραγωγή αυτών των ιόντων υδροξειδίου που προσδίδει τη χαρακτηριστική βασικότητα της αμμωνίας. Ωστόσο, δεν αντιδρά όλη η διαλυμένη αμμωνία με το νερό για να δώσει ιόντα αμμωνίου, κάτι που κάνει την αμμωνία αδύναμη βάση.
Επιπλέον, το ιόν αμμωνίου δρα ως ασθενές οξύ σε υδατικά διαλύματα επειδή διασπάται στο νερό για να σχηματίσει αμμωνία και ιόν υδρογόνου.
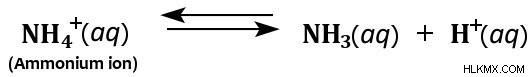
Ως εκ τούτου, αν και η αμμωνία θεωρείται ως επί το πλείστον αδύναμη βάση, μπορεί επίσης να δράσει ως ασθενές οξύ σε υδατικά διαλύματα.