Είναι το υδροφθορικό οξύ ένα ισχυρό ή αδύναμο οξύ;

Το υδροφθορικό οξύ ή HF είναι ένα εξαιρετικά ισχυρό, διαβρωτικό οξύ. Ωστόσο, ταξινομείται ως ασθενές οξύ παρά ως ισχυρό οξύ. Αυτό καθιστά το HF το μόνο υδραλογονικό οξύ που δεν ταξινομείται ως ισχυρό οξύ (π.χ. HCl, HBr, HI).
Γιατί το υδροφθορικό οξύ είναι αδύναμο οξύ
Ο απλός λόγος που το υδροφθορικό οξύ είναι ασθενές οξύ είναι επειδή δεν διασπάται πλήρως στα ιόντα του στο νερό (ο ορισμός του ισχυρού οξέος). Αρχικά, το HF στην πραγματικότητα κάνει διαχωρίστε σχεδόν πλήρως:
HF + H2 O ⇆ H3 O + F
Ωστόσο, μετά τη διάσπαση του οξέος, συμμετέχει σε άλλες αντιδράσεις με τον εαυτό του και με το νερό. Η συμπεριφορά του υδροφθορικού οξέος εξαρτάται σε μεγάλο βαθμό από τη συγκέντρωσή του στο νερό. Το κατιόν υδρονίου και το ανιόν φθορίου έλκονται ισχυρά μεταξύ τους και σχηματίζουν H3 O · F. Ο χημικός δεσμός σε αυτό το είδος είναι αρκετά ισχυρός ώστε να περιορίζει την οξύτητα, επομένως το υδροφθορικό οξύ είναι ένα πολύ ασθενές οξύ σε αραιό διάλυμα.
Τα συμπυκνωμένα διαλύματα HF συμπεριφέρονται σαν ένα ισχυρό οξύ. Αυτό οφείλεται στην ομοσύνδεση, στην οποία σχηματίζεται ένας χημικός δεσμός μεταξύ μιας βάσης και ενός συζυγούς οξέος:
3 HF ⇆ H2 F + HF2
Ο δεσμός υδρογόνου μεταξύ υδρογόνου και φθορίου σταθεροποιεί το διφθοριούχο ιόν FHF. Ο δεσμός υδρογόνου προκαλεί επίσης το HF να έχει υψηλότερο σημείο βρασμού από τα άλλα υδραλογονίδια.
Το HF είναι πολικό;
Δύο παράγοντες παίζουν στην ισχύ του οξέος:το μέγεθος του ατόμου και η πολικότητα του δεσμού Η-Α (όπου Α είναι το οξύ). Το φθόριο είναι εξαιρετικά ηλεκτραρνητικό, επομένως ο δεσμός στο HF είναι ένας πολικός ομοιοπολικός δεσμός. Όσο πιο πολικός είναι ένας δεσμός, τόσο πιο εύκολο είναι να αφαιρεθεί το πρωτόνιο ή το υδρογόνο από το οξύ. Έτσι, το υδροχλωρικό οξύ (HCl) είναι ισχυρότερο οξύ από το υδροβρωμικό οξύ (HBr). Με βάση μόνο την πολικότητά του, θα περίμενε κανείς ότι το HF θα είναι ισχυρότερο από το HCl. Όμως, η HF συμμετέχει σε αντιδράσεις μετά τη διάσπαση που το καθιστούν ασθενέστερο οξύ!
Αδύναμο αλλά επικίνδυνο
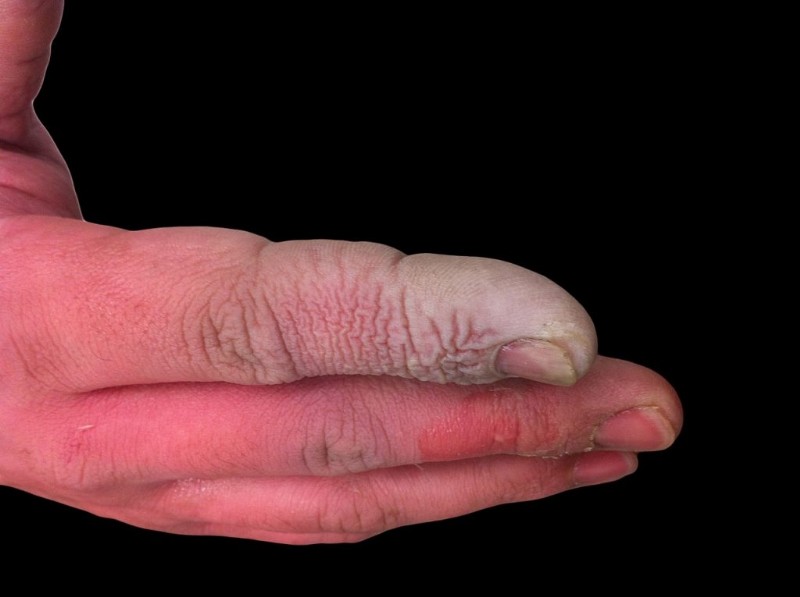
Αν και το HF είναι ένα ασθενές οξύ, είναι εξαιρετικά διαβρωτικό. Προσβάλλει το γυαλί, ακόμη και σε αραιό διάλυμα, επομένως πρέπει να φυλάσσεται σε πλαστικά δοχεία. Είναι επικίνδυνο να δουλεύεις για μερικούς λόγους. Πρώτον, η HF παρεμβαίνει στη λειτουργία των νεύρων, επομένως η έκθεση δεν είναι αμέσως επώδυνη όπως θα ήταν με άλλα οξέα. Δεύτερον, απορροφάται μέσω του ιστού, επομένως δεν προκαλεί χημικό έγκαυμα στο δέρμα ή στους βλεννογόνους. Τελικά, το οξύ εισχωρεί βαθύτερα στους ιστούς, προκαλώντας βλάβη στα οστά και συσσώρευση υγρού στους πνεύμονες. Ένα έγκαυμα με υδροφθορικό οξύ μπορεί να μην φαίνεται σοβαρό, αλλά απαιτεί άμεση προσοχή.
Αναφορές
- Favre, Henri A.; Powell, Warren H., eds. (2014). Ονοματολογία Οργανικής Χημείας:Συστάσεις και προτιμώμενες ονομασίες IUPAC 2013 . Cambridge:The Royal Society of Chemistry. ISBN 9781849733069.
- Giguère, Paul A.; Turrell, Sylvia (1980). «Η φύση του υδροφθορικού οξέος. Μια φασματοσκοπική μελέτη του συμπλόκου μεταφοράς πρωτονίων H3 ΤΟΥ". J. Είμαι. Chem. Soc . 102 (17):5473. doi:10.1021/ja00537a008
- Prkić, Ante; Giljanović, Josipa; Bralić, Marija; Boban, Katarina (2012). «Άμεσος ποτενσιομετρικός προσδιορισμός ειδών φθορίου με χρήση ηλεκτροδίου επιλεκτικού φθορίου». Int. J. Electrochem. Sci . 7:1170–1179.




