Υπερχλωρικό Οξύ – Δομή, Ιδιότητες, Χρήσεις του HClO4
Πρέπει να γνωρίζετε ότι ο περιοδικός πίνακας έχει 18 ομάδες. Κάθε ομάδα έχει τις δικές της διαφορετικές ιδιότητες και χαρακτηριστικά. Το ίδιο ισχύει και για την ομάδα αλογόνου. Τα στοιχεία της οικογένειας αλογόνου έχουν μικρό μέγεθος και την υψηλότερη ηλεκτραρνητικότητα μεταξύ άλλων ομάδων. Λόγω του συμπαγούς τους μεγέθους και της υψηλής ηλεκτραρνητικότητας τους, σχηματίζουν οξοξέα. Τώρα το ερώτημα είναι τι είναι τα οξοξέα; Στα οξοξέα αλογόνων, ένα άτομο αλογόνου (εκτός του φθορίου) σχηματίζει έναν ή περισσότερους δεσμούς με ένα άτομο οξυγόνου ή άτομα υδροξειδίου. Με αυτόν τον τρόπο, όλα τα αλογόνα σχηματίζουν οξοξέα. Αλλά το καθένα έχει διαφορετικές ιδιότητες, χρήσεις, δομές και πολλά άλλα χαρακτηριστικά.
Σε αυτό το άρθρο, θα μάθετε για το υπερχλωρικό οξύ ή το οξυόξινο χλώριο.
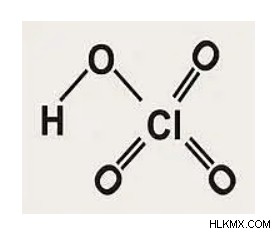
Δομή του υπερχλωρικού οξέος, HClO 4
Καθώς είναι ένα οξοξύ του χλωρίου, το κεντρικό άτομο του υπερχλωρικού οξέος ή του υδροχλωρικού οξέος είναι το άτομο χλωρίου. Τέσσερα άτομα οξυγόνου το συνδέουν ομοιοπολικά. Για την ακρίβεια, το άτομο χλωρίου στο υπερχλωρικό οξύ περιβάλλεται από τρία άτομα οξυγόνου και μία ομάδα υδροξειδίου. Και τα τρία άτομα οξυγόνου σχηματίζουν διπλούς δεσμούς με το άτομο χλωρίου. Είναι η εκπλήρωση του κανόνα της οκτάδας. Καθώς ένα άτομο χλωρίου μπορεί να επεκτείνει το κέλυφος σθένους του, σχηματίζει διπλούς δεσμούς με τρία άτομα οξυγόνου. Η ομάδα υδροξειδίου συνδέεται με το άτομο χλωρίου μέσω ενός μόνο δεσμού με αυτό. Το υδρογόνο στην ομάδα του υδροξειδίου καθιστά το υπερχλωρικό οξύ το ισχυρότερο οξύ, καθώς απελευθερώνεται εύκολα σε υδατικά διαλύματα.
Η δομή του υπερχλωρικού οξέος δίνεται παρακάτω.
Παρασκευή υπερχλωρικού οξέος, HClO4
Υπάρχουν μερικοί τρόποι παρασκευής αυτού του οξέος. Μερικά από αυτά είναι
1. Από το υπερχλωρικό οξύ, HClO3 :
Το υπερχλωρικό οξύ παρασκευάζεται με θέρμανση υπερχλωρικού οξέος.
3HClO3 + θερμότητα → HClO4 + Cl2 + 2O2 + H2 O
2. Από υπερχλωρικό κάλιο, KClO4 :
Το άνυδρο υπερχλωρικό οξύ λαμβάνεται με απόσταξη μείγματος KClO4 με συμπυκνωμένο H2 SO4 υπό μειωμένη πίεση.
KClO4 + H2 SO4 → HClO4 + KHSO4
3. Από υπερχλωρικό βάριο, Ba(ClO4 )2 :
Το διάλυμα υπερχλωρικού οξέος λαμβάνεται με επεξεργασία Ba(ClO4 )2 με υπολογισμένη ποσότητα αραιού H2 SO4 και στη συνέχεια αφαιρώντας το αδιάλυτο BaSO4 με διήθηση.
Ba(ClO4 )2 + H2 SO4 → 2HClO4 + BaSO4 ↓
4. Από υπερχλωρικό αμμώνιο, NH4 ClO4 :
Το διάλυμα υπερχλωρικού οξέος ή υπερχλωρικού οξέος μπορεί επίσης να ληφθεί με την προσθήκη NH4 ClO4 διαλύεται σε πυκνό HCl για να ζεσταθεί το πυκνό HNO3 και μετά εξατμίζεται.
NH4 ClO4 + 8HCl + 3HNO3 → HClO4 + 2N2 O + 4Cl2 + 7H2 O
Ιδιότητες του υπερχλωρικού οξέος, HClO4
Οι ιδιότητες του υπερχλωρικού οξέος ή του υπερχλωρικού οξέος κατηγοριοποιούνται σε δύο κατηγορίες, δηλαδή φυσικές και χημικές.
Οι φυσικές ιδιότητες του υπερχλωρικού οξέος είναι
- Περχλωρικό οξύ, HClO4 , είναι κοινώς γνωστό ως υδροξιδοτριοξειδοχλώριο ή υπερχλωρικό οξύ.
- Έχει άχρωμη, διαυγή και άοσμη φυσική εμφάνιση.
- Γενικά, το υπερχλωρικό οξύ υπάρχει ως υδατικό διάλυμα.
- Είναι διαβρωτικό για μέταλλα και ιστούς.
- Ο χημικός τύπος του υπερχλωρικού οξέος είναι HClO4 .
- Το σημείο τήξης του HClO4 είναι −17°C και το σημείο βρασμού του είναι 203°C.
- Μοριακό βάρος υπερχλωρικού οξέος, HClO4 , είναι 100,46 g/mol.
- Η πυκνότητά του είναι 1,768 g/cm.
- Η τιμή pKa του υδατικού διαλύματός του είναι −15,2±2,0.
Οι χημικές ιδιότητες του υπερχλωρικού οξέος, HClO4 , είναι
- HClO4 είναι το ισχυρότερο οξύ από όλα τα οξέα.
- Είναι ένα πολύ επικίνδυνο οξύ και προκαλεί σοβαρές πληγές στο δέρμα.
- Είναι ένας ισχυρός οξειδωτικός παράγοντας και φουσκώνει το χαρτί και το ξύλο.
- Σχηματίζει υδρίτες με 1, 2, 2,5, 3 και 3,5 μόρια νερού μετά την κρυστάλλωση.
- HClO4 δεν ανάγεται από το εκκολαπτόμενο υδρογόνο αλλά μετατρέπεται σε χλώριο από ισχυρούς αναγωγικούς παράγοντες όπως το SnCl2 , CrCl2 , κ.λπ.
- Αυτό το οξύ είναι ασταθές και αποσυντίθεται με την έκρηξη κατά τη θέρμανση. Μερικές φορές, απλώς στεκόταν για λίγες μέρες, ακόμα και στο σκοτάδι.
- Το διάλυμα υπερχλωρικού οξέος είναι αρκετά σταθερό και δεν αποσυντίθεται.
- Στην αφυδάτωση με P2 O5 στους -10℃, δίνει Cl2 O7 , ο ανυδρίτης του υπερχλωρικού οξέος.
2HClO4 + P2 O5 → Cl2 O7 + 2HPO3
Αυτή η αντίδραση έχει χρησιμοποιηθεί για την παρασκευή του Cl2 O7 .
- Άνυδρο υπερχλωρικό οξύ, HClO4 , είναι ένα άχρωμο κινητό υγροσκοπικό και ελαιώδες υγρό.
- Το άνυδρο υπερχλωρικό οξύ αναθυμιάζεται έντονα στον υγρό αέρα.
- Άνυδρο HClO4 διαλύεται στο νερό με ένα σφύριγμα λόγω της απελευθέρωσης της αφαίρεσης πολλής θερμότητας.
- Τα μέταλλα όπως ο Zn, ο Fe κ.λπ., διαλύονται στο υδατικό διάλυμα του οξέος και σχηματίζουν διαλυτά υπερχλωρικά.
Zn + 2HClO4 (aq) → Zn(ClO4 )2 (aq) + H2 ↓
- Όταν ένα εναιώρημα ιωδίου θερμαίνεται με HClO4 , παραπεριοδικό οξύ (H5 IO6 ) προκύπτει.
2HClO4 + I2 + 4H2 O → 2H5 IO6 + Cl2
Χρήσεις υπερχλωρικού οξέος, HClO4
Το υπερχλωρικό οξύ χρησιμοποιείται για πολλούς σκοπούς. Μερικές από τις κύριες χρήσεις του υπερχλωρικού οξέος δίνονται παρακάτω:
- Χρησιμοποιείται ως οξειδωτικό για τον διαχωρισμό του καλίου και του νατρίου σε πολλές εργαστηριακές δοκιμές.
- Είναι πρόδρομος του υπερχλωρικού αμμωνίου, ενός ζωτικού συστατικού καυσίμου πυραύλων.
- Χρησιμοποιείται στην κατασκευή εκρηκτικών.
- Χρησιμοποιείται ως κρίσιμη ένωση στη διαστημική βιομηχανία.
- Η αποσύνθεση του υπερχλωρικού οξέος κατά τη θέρμανση παράγει τοξικούς και διαβρωτικούς ατμούς.
- Χρησιμοποιείται στην επιμετάλλωση μετάλλων.
- Χρησιμοποιείται σε συστήματα χάραξης οθόνης υγρών κρυστάλλων (LCD).
- Είναι για ηλεκτροστίλβωση ή χάραξη χρωμίου και μολυβδαινίου.
- Λειτουργεί ως αντιδραστήριο για τον προσδιορισμό της 1Η-βενζοτριαζόλης.
- Παίζει σημαντικό ρόλο στην εξόρυξη υλικών από τα μεταλλεύματά τους.
- Λόγω της εξαιρετικά όξινης ιδιότητάς του, το υπερχλωρικό οξύ είναι ένα από τα κύρια συστατικά του Bronsted-Lowry.
- Λόγω της μοναδικής ιδιότητάς του, χρησιμοποιείται στην αναλυτική χημεία.
- Χρησιμοποιείται επίσης στη βιομηχανία ηλεκτρονικών.
- Είναι ισχυρό οξειδωτικό, που το καθιστά επικίνδυνο για φωτιά και έκρηξη.
Κίνδυνοι για την υγεία που προκαλούνται από το υπερχλωρικό οξύ
Αν και το υπερχλωρικό οξύ είναι πολύ χρήσιμο για πολλούς σκοπούς, προκαλεί σημαντικά προβλήματα υγείας.
- Η εισπνοή ατμών αυτής της ένωσης προκαλεί αίσθημα καύσου στη μύτη, το λαιμό και τους πνεύμονες.
- Η παρατεταμένη έκθεση σε αυτήν την ένωση προκαλεί εμετό.
- Η κατάποση αυτής της ένωσης μπορεί να προκαλέσει φουσκάλες και εγκαύματα στο στομάχι.
- Είναι πολύ διαβρωτικό και για το ανθρώπινο δέρμα.
- Λόγω της οξειδωτικής του φύσης, είναι εξαιρετικά αντιδραστικό προς τα περισσότερα μέταλλα. Απελευθερώνει ερεθιστικά, διαβρωτικά και τοξικά αέρια όταν θερμαίνεται. Επομένως, αυτή η ένωση πρέπει να αντιμετωπίζεται με επαρκή μέτρα ασφαλείας.
Μερικά σημεία που πρέπει να θυμάστε
Ακολουθούν τα σημαντικά σημεία:
- Το υπερχλωρικό οξύ είναι ένα οξοοξύ χλωρίου με τύπο HClO4
- Ονομάζεται επίσης υπερχλωρικό οξύ ή υδροξυδοτριοξειδοχλώριο
- Είναι ένα άοσμο και άχρωμο υδατικό διάλυμα σε τυπική θερμοκρασία.
- Είναι επικίνδυνα διαβρωτικό και έτσι σχηματίζει εύκολα εκρηκτικά μείγματα.
- Δρα ως ισχυρό οξειδωτικό όταν είναι ζεστό, αλλά εμφανίζει όξινες ιδιότητες μόνο σε θερμοκρασία δωματίου.
- Αν και έχει τεράστιες χρήσεις, έχει βασική χρήση στη διαστημική βιομηχανία για την παραγωγή υπερχλωρικού αμμωνίου. Αυτό το υπερχλωρικό αμμώνιο είναι ένα κύριο συστατικό του καυσίμου πυραύλων.
- Στο εμπόριο, αυτό το οξύ είναι διαθέσιμο σε νερό με συγκέντρωση 70% (κατά βάρος).
- Υπάρχουν δύο κύριοι τρόποι βιομηχανικής παραγωγής.
- Είναι ένα από τα ισχυρότερα οξέα Bronsted–Lowry.
Μέτρα Ασφαλείας
Κάποιος πρέπει να ακολουθεί τις δεδομένες προφυλάξεις ασφαλείας κατά την εργασία με υπερχλωρικό οξύ στο εργαστήριο.
- Το χειρίζονται μόνο προσωπικοί εκπαιδευτές εργαστηρίου.
- Χρησιμοποιήστε κατάλληλα προστατευτικά μέτρα κατά την εργασία με αυτό.
- Αποφύγετε τη χρήση υπερχλωρικού οξέος με οργανικές ουσίες όπως κυτταρίνη, λιπίδια, λίπη κ.λπ.
- Ποτέ μην θερμαίνετε το υπερχλωρικό οξύ σε λουτρό λαδιού ή σε ανοιχτή φλόγα.
- Μην το χρησιμοποιείτε με άλλα χημικά προτού μάθετε τη φύση του μαζί τους.
- Πλύντε τους απορροφητήρες υπερχλωρικού οξέος μετά από κάθε χρήση.
- Μην αποστάζετε υπερχλωρικό οξύ στο κενό γιατί θα σχηματιστεί ένας ασταθής ανυδρίτης.
Συμπέρασμα
Το HClO4, υπερχλωρικό οξύ ή οξοοξύ χλωρίου, παράγεται από την αντίδραση υπερχλωρικών αλκαλίων με υδροχλωρικό οξύ ή υπερχλωρικό βάριο με θειικό οξύ σε εργαστήριο. Αν και χρησιμοποιείται για τον διαχωρισμό του καλίου και του νατρίου, η κύρια λειτουργία του είναι η παρασκευή ενός ζωτικού συστατικού καυσίμου πυραύλων, δηλαδή το υπερχλωρικό αμμώνιο. Επίσης, έχει πλεονέκτημα σε πολλές εργαστηριακές δοκιμές και βιομηχανικές διαδικασίες.
Συχνές ερωτήσεις
1. Γιατί πρέπει το υπερχλωρικό οξύ να χρησιμοποιείται με τη μέγιστη προσοχή και προφύλαξη;
Α. Το υπερχλωρικό οξύ ή υπερχλωρικό οξύ είναι ένα από τα ισχυρά μεταλλικά οξέα. Έχει υψηλή οξειδωτική ισχύ σε υψηλές θερμοκρασίες. Ως αποτέλεσμα, είναι πολύ κατάλληλο για την πέψη οργανικής ύλης όπως πρωτεΐνες, λίπη και λιπίδια. Τα υπερχλωρικά που παράγονται κατά την αποσύνθεσή του είναι εύκολα διαλυτά στο νερό. Πρέπει να το χειρίζεστε με εξαιρετική προσοχή λόγω της ταχείας αντιδραστικότητάς του με οργανική ύλη γιατί μερικές φορές μπορεί να γίνει εκρηκτικό.
2. Είναι το υπερχλωρικό οξύ το ισχυρότερο οξύ;
Α. Ναι. Το υπερχλωρικό οξύ είναι ένα από τα πιο ισχυρά οξέα. Είναι λόγω της παρουσίας υπερχλωρικού οξέος ή υπερχλωρικού. Αυτό το υπερχλωρικό είναι ένα ασθενές πυρηνόφιλο και δεν παρουσιάζει υδρόλυση σε σύγκριση με άλλα οξέα. Ως αποτέλεσμα, απελευθερώνει εύκολα ιόντα H+ σε υδατική κατάσταση, σχηματίζοντας ένα ισχυρό οξύ.
3. Τι συμβαίνει όταν το υπερχλωρικό οξύ αντιδρά με μέταλλα;
Α. Το υπερχλωρικό οξύ αντιδρώντας με μέταλλα σχηματίζει εύφλεκτο ή εκρηκτικό αέριο. Είναι πολύ οξειδωτικό και μπορεί να προκαλέσει κίνδυνο πυρκαγιάς ή έκρηξης όταν έρχεται σε επαφή με οργανική ύλη. Όταν παίρνει θερμότητα, αποσυντίθεται και παράγει τοξικούς και διαβρωτικούς ατμούς.
4. Τι άλλο από το υπερχλωρικό οξύ και τα οξυ-οξέα σχηματίζεται το άτομο χλωρίου;
Α. Το χλώριο σχηματίζει τέσσερα οξυ-οξέα, τα οποία είναι υποχλωριώδες οξύ (HCl+1O), χλωρικό οξύ (HCl+3O2), χλωρικό οξύ (HCl+5O3) και υπερχλωρικό οξύ (HCl+7O4). Οι καταστάσεις οξείδωσης των ατόμων χλωρίου είναι +1, +3, +5 και +7, αντίστοιχα, σε αυτά τα οξέα.




