Το μοντέλο του ατόμου Bohr
Το μοντέλο Bohr ή μοντέλο Rutherford-Bohr του ατόμου είναι ένα κέικ ή πλανητικό μοντέλο που περιγράφει τη δομή των ατόμων κυρίως με όρους κβαντικής θεωρίας. Ονομάζεται πλανητικό μοντέλο ή μοντέλο κέικ επειδή τα ηλεκτρόνια περιφέρονται γύρω από τον ατομικό πυρήνα όπως οι πλανήτες γύρω από τον Ήλιο, ενώ οι κυκλικές τροχιές ηλεκτρονίων σχηματίζουν κελύφη, όπως τα στρώματα ενός κέικ. Ο Δανός φυσικός Niels Bohr πρότεινε το μοντέλο το 1913.
Το μοντέλο του Bohr ήταν το πρώτο ατομικό μοντέλο που ενσωμάτωσε κάποια κβαντική μηχανική. Προηγούμενα μοντέλα ήταν το κυβικό μοντέλο (1902), το μοντέλο με δαμάσκηνο (1904), το μοντέλο του Κρόνου (1904) και το μοντέλο του Ράδερφορντ (1911). Τελικά, μοντέλα βασισμένα εξ ολοκλήρου στην κβαντική μηχανική αντικατέστησαν το μοντέλο του Bohr. Ωστόσο, είναι ένα σημαντικό μοντέλο επειδή περιγράφει την κβαντική συμπεριφορά των ηλεκτρονίων με απλά λόγια και εξηγεί τον τύπο Rydberg για τις φασματικές γραμμές εκπομπής υδρογόνου.
Βασικά σημεία του μοντέλου Bohr
- Ο ατομικός πυρήνας αποτελείται από πρωτόνια και νετρόνια και έχει καθαρό θετικό φορτίο.
- Τα ηλεκτρόνια έχουν αρνητικό φορτίο και περιφέρονται γύρω από τον πυρήνα.
- Οι τροχιές των ηλεκτρονίων είναι κυκλικές, αλλά δεν περιστρέφονται όλα τα ηλεκτρόνια στο ίδιο επίπεδο (όπως οι πλανήτες γύρω από ένα αστέρι), με αποτέλεσμα να δημιουργούνται σφαίρες ή κελύφη όπου μπορεί να βρεθεί ένα ηλεκτρόνιο. Ενώ η βαρύτητα καθορίζει τις τροχιές των πλανητών γύρω από τα αστέρια, οι ηλεκτροστατικές δυνάμεις (δύναμη Coulomb) αναγκάζουν τα ηλεκτρόνια να περιφέρονται γύρω από τον πυρήνα.
- Η χαμηλότερη ενέργεια για ένα ηλεκτρόνιο (η πιο σταθερή κατάσταση) βρίσκεται στη μικρότερη τροχιά, η οποία είναι πιο κοντά στον πυρήνα.
- Όταν ένα ηλεκτρόνιο μετακινείται από τη μια τροχιά στην άλλη, απορροφάται ενέργεια (μετακινείται από χαμηλότερη σε υψηλότερη τροχιά) ή εκπέμπεται (μετακινείται από υψηλότερη σε χαμηλότερη τροχιά).
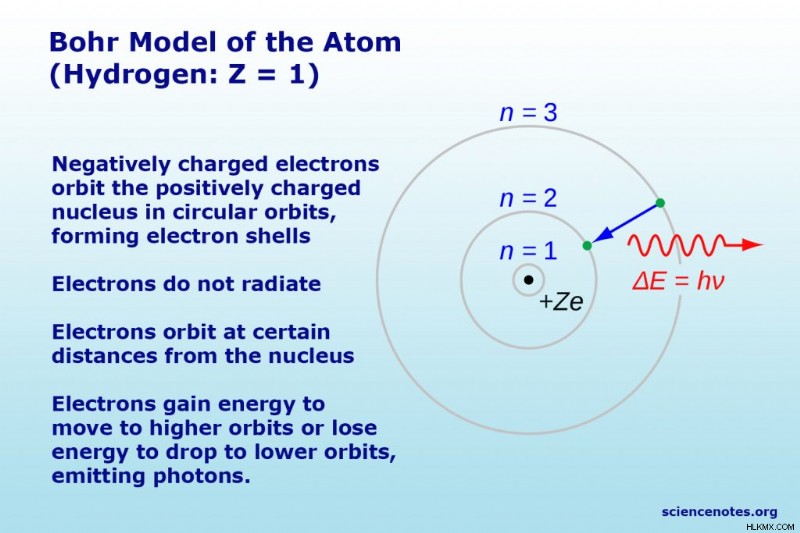
Το μοντέλο του Bohr του υδρογόνου
Το απλούστερο παράδειγμα του μοντέλου Bohr είναι για το άτομο υδρογόνου (Z =1) ή για ένα ιόν τύπου υδρογόνου (Z> 1), στο οποίο ένα αρνητικά φορτισμένο ηλεκτρόνιο περιφέρεται γύρω από έναν μικρό θετικά φορτισμένο πυρήνα. Σύμφωνα με το μοντέλο, τα ηλεκτρόνια καταλαμβάνουν μόνο ορισμένες τροχιές. Η ακτίνα των πιθανών τροχιών αυξάνεται συναρτήσει του n, όπου n είναι ο κύριος κβαντικός αριθμός. Εάν ένα ηλεκτρόνιο μετακινηθεί από τη μια τροχιά στην άλλη, η ενέργεια απορροφάται ή εκπέμπεται. Η μετάβαση 3 → 2 παράγει την πρώτη σειρά της σειράς Balmer. Για το υδρογόνο (Z =1), αυτή η γραμμή αποτελείται από φωτόνια με μήκος κύματος 656 nm (κόκκινο).
Μοντέλο Bohr για βαρύτερα άτομα
Το άτομο υδρογόνου περιέχει μόνο ένα πρωτόνιο, ενώ τα βαρύτερα άτομα περιέχουν περισσότερα πρωτόνια. Τα άτομα απαιτούν επιπλέον ηλεκτρόνια για να ακυρώσουν το θετικό φορτίο πολλαπλών πρωτονίων. Σύμφωνα με το μοντέλο του Bohr, κάθε τροχιά περιέχει μόνο έναν ορισμένο αριθμό ηλεκτρονίων. Όταν γεμίσει το επίπεδο, πρόσθετα ηλεκτρόνια καταλαμβάνουν το επόμενο υψηλότερο επίπεδο. Έτσι, το μοντέλο Bohr για βαρύτερα ηλεκτρόνια εισάγει ηλεκτρονιακά κελύφη. Αυτό εξηγεί ορισμένες ιδιότητες των βαρέων ατόμων, όπως γιατί τα άτομα μικραίνουν καθώς μετακινείστε από αριστερά προς τα δεξιά σε μια περίοδο (σειρά) του περιοδικού πίνακα, παρόλο που περιέχουν περισσότερα πρωτόνια και ηλεκτρόνια. Το μοντέλο εξηγεί επίσης γιατί τα ευγενή αέρια είναι αδρανή, γιατί τα άτομα στην αριστερή πλευρά του περιοδικού πίνακα προσελκύουν ηλεκτρόνια και γιατί τα στοιχεία στη δεξιά πλευρά (εκτός από τα ευγενή αέρια) χάνουν ηλεκτρόνια.
Ένα πρόβλημα με την εφαρμογή του μοντέλου Bohr σε βαρύτερα άτομα είναι ότι το μοντέλο υποθέτει ότι τα κελύφη ηλεκτρονίων δεν αλληλεπιδρούν. Έτσι, το μοντέλο δεν εξηγεί γιατί τα ηλεκτρόνια δεν στοιβάζονται με κανονικό τρόπο.
Προβλήματα με το μοντέλο Bohr
Ενώ το μοντέλο Bohr ξεπέρασε τα προηγούμενα μοντέλα και περιέγραψε φάσματα απορρόφησης και εκπομπής, είχε ορισμένα προβλήματα:
- Το μοντέλο δεν μπορούσε να προβλέψει φάσματα μεγάλων ατόμων.
- Δεν εξηγεί το φαινόμενο Zeeman.
- Δεν προβλέπει σχετικές εντάσεις φασματικών γραμμών.
- Το μοντέλο παραβιάζει την Αρχή της Αβεβαιότητας του Heisenberg επειδή ορίζει τόσο την ακτίνα όσο και την τροχιά των ηλεκτρονίων.
- Υπολογίζει λανθασμένα τη γωνιακή ορμή της θεμελιώδους κατάστασης. Σύμφωνα με το μοντέλο του Bohr, η γωνιακή ορμή θεμελιώδους κατάστασης είναι L =ħ . Τα πειραματικά δεδομένα δείχνουν L=0.
- Το μοντέλο Bohr δεν εξηγεί τη λεπτή και υπερλεπτή δομή των φασματικών γραμμών.
Βελτιώσεις στο μοντέλο Bohr
Το μοντέλο Sommerfeld ή Bohr-Sommerfeld βελτιώθηκε σημαντικά σε σχέση με το αρχικό μοντέλο Bohr περιγράφοντας ελλειπτικές τροχιές ηλεκτρονίων αντί για κυκλικές τροχιές. Αυτό επέτρεψε στο μοντέλο Sommerfeld να εξηγήσει τα ατομικά φαινόμενα, όπως το φαινόμενο Stark στη διάσπαση φασματικών γραμμών. Ωστόσο, το μοντέλο Sommerfeld δεν μπορούσε να φιλοξενήσει τον μαγνητικό κβαντικό αριθμό.
Το 1925, το ατομικό μοντέλο Pauli του Wolfgang αντικατέστησε το μοντέλο Bohr και αυτά που βασίστηκαν σε αυτό. Το μοντέλο του Pauli βασίστηκε καθαρά στην κβαντική μηχανική, επομένως εξηγούσε περισσότερα φαινόμενα από το μοντέλο Bohr. Το 1926, η εξίσωση του Erwin Schrodinger εισήγαγε την κυματομηχανική, οδηγώντας στις τροποποιήσεις του μοντέλου του Pauli που χρησιμοποιούνται σήμερα.
Αναφορές
- Bohr, Niels (1913). «Σχετικά με το Σύνταγμα των ατόμων και των μορίων, Μέρος Ι». Philosophical Magazine . 26 (151):1–24. doi:10.1080/14786441308634955
- Bohr, Niels (1914). «Τα φάσματα ηλίου και υδρογόνου». Φύση . 92 (2295):231–232. doi:10.1038/092231d0
- Lakhtakia, Akhlesh; Salpeter, Edwin E. (1996). «Μοντέλα και Μοντελιστές Υδρογόνου». American Journal of Physics . 65 (9):933. Bibcode:1997AmJPh..65..933L. doi:10.1119/1.18691
- Pauling, Linus (1970). «Κεφάλαιο 5-1». Γενική Χημεία (3η έκδ.). Σαν Φρανσίσκο:W.H. Freeman &Co. ISBN 0-486-65622-5.