Πώς να υπολογίσετε το μοριακό βάρος του πολυμερούς
Τα πολυμερή περιέχουν ένα ευρύ φάσμα αλυσίδων με διαφορετικό μοριακό βάρος, σε αντίθεση με πολλές άλλες ουσίες. Έτσι, δεν μπορούμε να υπολογίσουμε το ακριβές μοριακό βάρος ενός πολυμερούς. Αντίθετα, υπολογίζουμε το μέσο μοριακό βάρος ενός πολυμερούς. Είναι πολύ σημαντικό να προσδιοριστεί το μέσο μοριακό βάρος ενός πολυμερούς, καθώς οι ιδιότητές του εξαρτώνται από αυτό. Για παράδειγμα, ένα πολυμερές με μεγάλο μέσο μοριακό βάρος θα συμπεριφερόταν με εντελώς διαφορετικό τρόπο από ένα πολυμερές με μικρό μέσο μοριακό βάρος. Υπάρχουν διάφορες προσεγγίσεις για τον υπολογισμό των μέσων μοριακών βαρών των πολυμερών, συμπεριλαμβανομένης της ιξωδομετρίας, της ωσμομετρίας, της χρωματογραφίας αποκλεισμού μεγέθους, της υπερφυγοκέντρησης, της σκέδασης φωτός, της ανάλυσης τελικής ομάδας και της θολόμετρης τιτλοδότησης.
Αυτό το άρθρο εστιάζει σε,
1. Πώς να υπολογίσετε το μοριακό βάρος του πολυμερούς;
– Αριθμός-μέσο μοριακό βάρος
– Μέσο μοριακό βάρος βάρους
2. Τι είναι η Ιξωδομετρία;
3. Τι είναι η υπερφυγοκέντρηση;
Πώς να υπολογίσετε το μοριακό βάρος του πολυμερούς
Υπάρχουν δύο συνήθεις τρόποι για τον υπολογισμό του μέσου μοριακού βάρους των πολυμερών, εάν είναι γνωστές οι κατανομές μοριακού βάρους.
Αριθμητικό μέσο μοριακό βάρος
Η πρώτη μέθοδος είναι το μέσο αριθμητικό μοριακό βάρος ( Ḿ n ) , το οποίο βρίσκεται από την εξίσωση;
Ḿ n = Σ xi Μi
Mi είναι το μέσο μόριο του εύρους μεγέθους i και xi είναι το κλάσμα του συνολικού αριθμού των αλυσίδων εντός του δεδομένου εύρους.
Μοριακό βάρος μέσου βάρους
Η δεύτερη μέθοδος είναι το μέσο μοριακό βάρος (Ḿw ) , που βρέθηκε με εξίσωση;
Ḿ w = Σ wi Μi
Mi είναι το μέσο μόριο του εύρους μεγέθους i και wi είναι το κλάσμα βάρους των μορίων εντός του δεδομένου εύρους.
Τι είναι η ιξωδομετρία
Η πιο κοινή τεχνική που χρησιμοποιείται για τον προσδιορισμό του μέσου μοριακού βάρους ενός πολυμερούς είναι η ιξωδομετρία, όπου χρησιμοποιείται ιξωδόμετρο Ubbelohde. Σε αυτή τη μέθοδο, το πολυμερές θα πρέπει να είναι σε υγρή μορφή. Εάν όχι, πρέπει να διαλυθεί χρησιμοποιώντας διαλύτη με γνωστή συγκέντρωση. Σύμφωνα με την εξίσωση Mark-Houwink, το μοριακό βάρος μπορεί να υπολογιστεί εάν το ιξώδες ( η ) είναι γνωστό.
η ] =K M ………………1
Το K και το a είναι γνωστές σταθερές που εξαρτώνται από τον διαλύτη, τον τύπο του πολυμερούς και τη θερμοκρασία.
Η τιμή του [η] μπορεί να προσδιοριστεί με σχεδίαση ((η- η0 )/ η0 γ) σε συνάρτηση με το c, όπου c είναι η συγκέντρωση του διαλύματος πολυμερούς. Για να προσδιοριστεί το η χρησιμοποιώντας ιξωδόμετρο, πρέπει πρώτα να γίνει μια σειρά από διαλύματα πολυμερών. Στη συνέχεια, ο χρόνος εκροής πρέπει να προσδιοριστεί για κάθε διάλυμα (t). Σύμφωνα με την εξίσωση Huggins,
(t – t0 ) / t0 c =( η – η ο)/ η 0 γ ……………2
t0 είναι ο χρόνος εκροής του καθαρού διαλύτη χωρίς πολυμερές. Χρησιμοποιώντας την παραπάνω εξίσωση 1 και 2, μπορούμε να προσδιορίσουμε το μέσο ιξώδες ενός πολυμερούς.
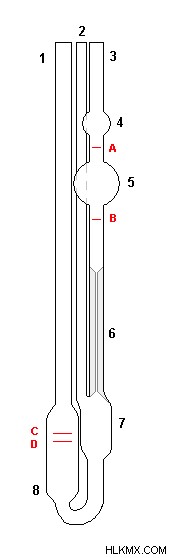
ιξωδόμετρο Ubbelohde
Τι είναι η Υπερφυγοκέντρηση
Σε αυτή τη μέθοδο, το μέσο μοριακό βάρος ενός πολυμερούς προσδιορίζεται με τη μέτρηση των ρυθμών καθίζησης. Ο ρυθμός καθίζησης των σωματιδίων είναι συνήθως πολύ αργός. Για να επιταχύνουμε τη διαδικασία, μπορούμε να χρησιμοποιήσουμε υπερφυγόκεντρο. Το μέσο μοριακό βάρος ενός πολυμερούς μπορεί να προσδιοριστεί από την ακόλουθη εξίσωση:
M=S R T / (1- ρν s ) Δ
M είναι το μοριακό βάρος του δείγματος, R είναι η καθολική σταθερά αερίου, T είναι η θερμοκρασία, ρ είναι η πυκνότητα του διαλύματος, ν s είναι ο ειδικός όγκος της διαλυμένης ουσίας, S είναι η σταθερά καθίζησης και D είναι ο συντελεστής διάχυσης.
Το S πρέπει να καθοριστεί πρώτα χρησιμοποιώντας την παρακάτω εξίσωση.
S=s / r ω
s είναι η ταχύτητα, r είναι η ακτίνα και ω είναι η γωνιακή ταχύτητα.
Εκτός από αυτές τις κύριες τεχνικές, η χρωματογραφία, η ωσμομετρία, η σκέδαση φωτός, η ανάλυση τελικής ομάδας και οι μέθοδοι θολωσιμετρικής τιτλοδότησης εφαρμόζονται επίσης για τον προσδιορισμό των μοριακών βαρών των πολυμερών. Ωστόσο, η πιο συχνά χρησιμοποιούμενη και η απλούστερη τεχνική είναι η ιξωδομετρία.
Αναφορές
Stuart, B. H. (2008).Ανάλυση πολυμερών (Τόμος 30). John Wiley &Sons.




