Τι είναι η ενέργεια ενεργοποίησης; Ορισμός και Παραδείγματα
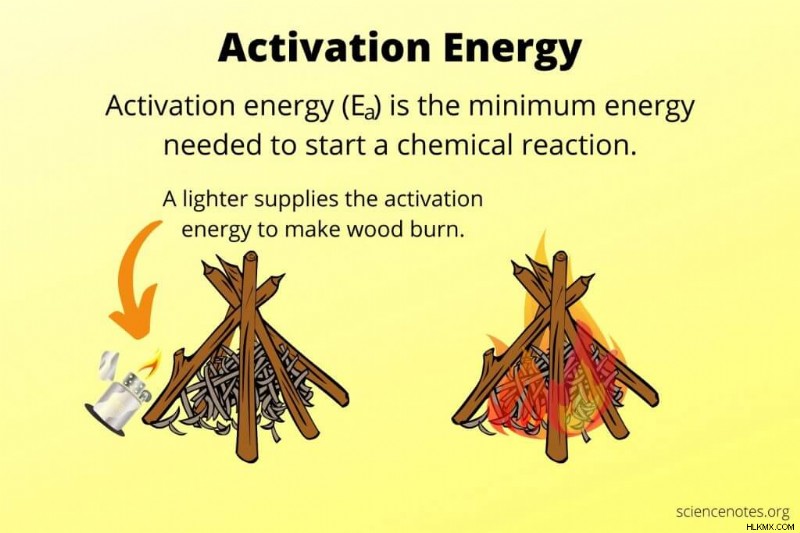
Στη χημεία και τη φυσική, ενέργεια ενεργοποίησης είναι η ελάχιστη ποσότητα ενέργειας που απαιτείται για την έναρξη μιας χημικής αντίδρασης. Τα αντιδρώντα συχνά λαμβάνουν ενέργεια ενεργοποίησης από τη θερμότητα, αλλά μερικές φορές η ενέργεια προέρχεται από το φως ή την ενέργεια που απελευθερώνεται από άλλες χημικές αντιδράσεις. Για αυθόρμητες αντιδράσεις, η θερμοκρασία περιβάλλοντος παρέχει αρκετή ενέργεια για να επιτευχθεί η ενέργεια ενεργοποίησης.
Ο Σουηδός επιστήμονας Svante Arrhenius πρότεινε την έννοια της ενέργειας ενεργοποίησης το 1889. Η ενέργεια ενεργοποίησης υποδεικνύεται με το σύμβολο Ea και έχει μονάδες joules (J), kilojoules ανά mole (kJ/mol) ή χιλιοθερμίδων ανά mole (kcal/mol).
Επίδραση ενζύμων και καταλυτών
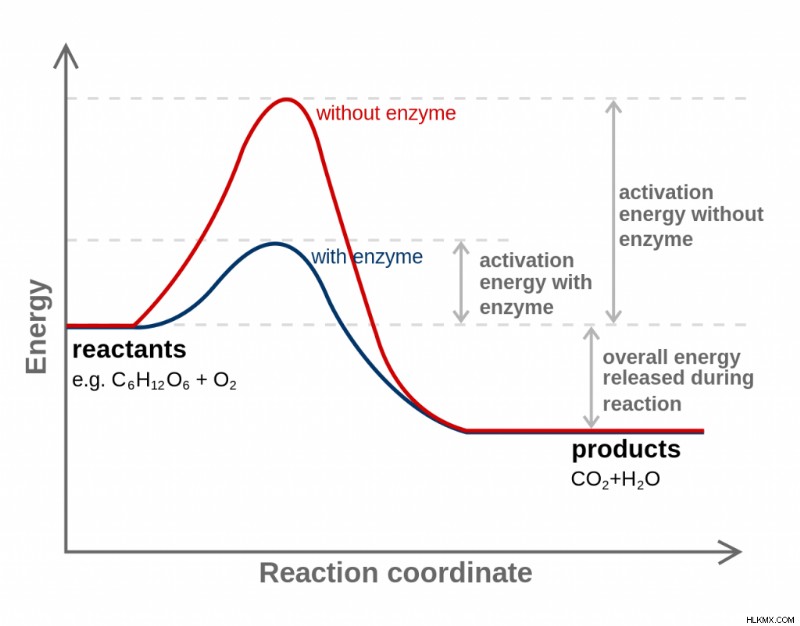
Ένας καταλύτης μειώνει την ενέργεια ενεργοποίησης μιας χημικής αντίδρασης. Τα ένζυμα είναι παραδείγματα καταλυτών. Οι καταλύτες δεν καταναλώνονται από τη χημική αντίδραση και δεν αλλάζουν τη σταθερά ισορροπίας της αντίδρασης. Συνήθως, λειτουργούν τροποποιώντας τη μεταβατική κατάσταση της αντίδρασης. Βασικά, δίνουν μια αντίδραση άλλο τρόπο για να προχωρήσουμε. Όπως η συντόμευση ανάμεσα σε δύο μέρη, η πραγματική απόσταση μεταξύ τους δεν αλλάζει, αλλά μόνο η διαδρομή.
Οι αναστολείς, αντίθετα, αυξάνουν την ενέργεια ενεργοποίησης μιας χημικής αντίδρασης. Αυτό μειώνει τον ρυθμό της αντίδρασης.
Ενέργεια ενεργοποίησης και ρυθμός αντίδρασης
Η ενέργεια ενεργοποίησης σχετίζεται με τον ρυθμό αντίδρασης. Όσο υψηλότερη είναι η ενέργεια ενεργοποίησης, τόσο πιο αργά προχωρά η αντίδραση επειδή λιγότερα αντιδρώντα έχουν αρκετή ενέργεια για να ξεπεράσουν το ενεργειακό φράγμα σε κάθε δεδομένη στιγμή. Εάν η ενέργεια ενεργοποίησης είναι αρκετά υψηλή, μια αντίδραση δεν θα προχωρήσει καθόλου εάν δεν παρέχεται ενέργεια. Για παράδειγμα, η καύση ξύλου απελευθερώνει πολλή ενέργεια, αλλά ένα ξύλινο τραπέζι δεν φλέγεται ξαφνικά. Η καύση του ξύλου απαιτεί ενέργεια ενεργοποίησης, η οποία μπορεί να παρέχεται από έναν αναπτήρα.
Η εξίσωση Arrhenius περιγράφει τη σχέση μεταξύ του ρυθμού αντίδρασης, της ενέργειας ενεργοποίησης και της θερμοκρασίας.
k =Ae
Εδώ, k είναι ο συντελεστής ταχύτητας αντίδρασης, A είναι ο συντελεστής συχνότητας για την αντίδραση, e είναι ο παράλογος αριθμός (περίπου ίσος με 2,718), E α είναι η ενέργεια ενεργοποίησης, R είναι η καθολική σταθερά αερίου και T είναι η απόλυτη θερμοκρασία (Kelvin).
Η εξίσωση Arrhenius δείχνει ότι ο ρυθμός αντίδρασης αλλάζει με τη θερμοκρασία. Στις περισσότερες περιπτώσεις, οι χημικές αντιδράσεις προχωρούν πιο γρήγορα όσο αυξάνεται η θερμοκρασία (μέχρι ένα σημείο). Σε ορισμένες περιπτώσεις, ο ρυθμός αντίδρασης μειώνεται καθώς αυξάνεται η θερμοκρασία. Η επίλυση για ενέργεια ενεργοποίησης μπορεί να δώσει αρνητική τιμή.
Είναι δυνατή η αρνητική ενέργεια ενεργοποίησης;
Η ενέργεια ενεργοποίησης για μια στοιχειώδη αντίδραση είναι μηδενική ή θετική. Ωστόσο, ένας μηχανισμός αντίδρασης που αποτελείται από πολλά στάδια μπορεί να έχει αρνητική ενέργεια ενεργοποίησης. Επιπλέον, η εξίσωση Arrhenius επιτρέπει αρνητικές τιμές ενέργειας ενεργοποίησης σε περιπτώσεις όπου ο ρυθμός αντίδρασης μειώνεται καθώς αυξάνεται η θερμοκρασία. Οι στοιχειώδεις αντιδράσεις με αρνητικές ενέργειες ενεργοποίησης είναι αντιδράσεις χωρίς φραγμούς. Σε αυτές τις περιπτώσεις, η αύξηση της θερμοκρασίας μειώνει την πιθανότητα να συνδυαστούν τα αντιδρώντα επειδή έχουν υπερβολική ενέργεια. Μπορείτε να το σκεφτείτε σαν να πετάτε δύο κολλώδεις μπάλες η μία στην άλλη. Σε χαμηλές ταχύτητες, κολλάνε, αλλά αν κινούνται πολύ γρήγορα, αναπηδούν το ένα από το άλλο.
Ενέργεια ενεργοποίησης και ενέργεια Gibbs
Η εξίσωση Eyring είναι μια άλλη σχέση που περιγράφει τον ρυθμό αντίδρασης. Ωστόσο, η εξίσωση χρησιμοποιεί ενέργεια Gibbs της μεταβατικής κατάστασης αντί για ενέργεια ενεργοποίησης. Η ενέργεια Gibbs της μεταβατικής κατάστασης αντιπροσωπεύει την ενθαλπία και την εντροπία μιας αντίδρασης. Ενώ η ενέργεια ενεργοποίησης και η ενέργεια Gibbs σχετίζονται, δεν είναι εναλλάξιμα στις χημικές εξισώσεις.
Πώς να βρείτε την ενέργεια ενεργοποίησης
Χρησιμοποιήστε την εξίσωση Arrhenius για να βρείτε την ενέργεια ενεργοποίησης. Μια μέθοδος περιλαμβάνει την επανεγγραφή της εξίσωσης Arrhenius και την καταγραφή της αλλαγής στον ρυθμό αντίδρασης καθώς αλλάζει η θερμοκρασία:
log K =ημερολόγιο A – Ea /2.303RT
αρχείο καταγραφής (k2 /k1 ) =Ea / 2.303R(1/T1 −1/T2 )
Για παράδειγμα:Η σταθερά ταχύτητας μιας αντίδρασης πρώτης τάξης αυξάνεται από 3×10 σε 8×10 καθώς η θερμοκρασία αυξάνεται από 310K σε 330K. Υπολογίστε την ενέργεια ενεργοποίησης (Ea ).
log(8×10 / 3×10) =Ea/2.303R (1/310 – 1/330)
log 2,66 =Ea/2,303R (1,95503 x 10)
0,4249 Ea/2,303×8,314 x (1,95503 x 10)
0,4249 =Ea/19,147 x (1,95503 x 10)
0,4249 =1,02106 x 10 x Ea
Ea =41613,62 J/mol ή 41,614 kJ/mol
Μπορείτε να γράψετε γραφήματα ln k (φυσικός λογάριθμος της σταθεράς ρυθμού) έναντι 1/T και να χρησιμοποιήσετε την κλίση της γραμμής που προκύπτει για να βρείτε την ενέργεια ενεργοποίησης:
m =– Ea /R
Εδώ m είναι η κλίση της γραμμής, Ea είναι η ενέργεια ενεργοποίησης και R είναι η ιδανική σταθερά αερίου 8,314 J/mol-K. Θυμηθείτε να μετατρέψετε τυχόν μετρήσεις θερμοκρασίας σε Κελσίου ή Φαρενάιτ σε Κέλβιν πριν υπολογίσετε το 1/T και σχεδιάσετε το γράφημα.
Σε ένα διάγραμμα της ενέργειας της αντίδρασης έναντι της συντεταγμένης αντίδρασης, η διαφορά μεταξύ της ενέργειας των αντιδρώντων και της ενέργειας των προϊόντων είναι ΔΗ, ενώ η περίσσεια ενέργειας (το τμήμα της καμπύλης πάνω από αυτό των προϊόντων) είναι η ενεργοποίηση. ενέργεια.
Αναφορές
- Atkins, Peter; de Paula, Julio (2006). φυσική χημεία του Atkins (8η έκδ.). W.H.Freeman. ISBN 0-7167-8759-8.
- Espenson, James (1995). Χημική κινητική και μηχανισμοί αντίδρασης . McGraw-Hill. ISBN 0070202605.
- Laidler, Keith J.; Meiser, John H. (1982). Φυσική χημεία . Μπέντζαμιν/Κάμινγκς. ISBN 0-8053-5682-7.
- Mozurkewich, Michael; Benson, Sidney (1984). «Αρνητικές ενέργειες ενεργοποίησης και καμπύλες γραφές Arrhenius. 1. Θεωρία αντιδράσεων πάνω από πιθανά φρεάτια». J. Phys. Chem . 88 (25):6429–6435. doi:10.1021/j150669a073
- Wang, Jenqdaw; Raj, Rishi (1990). «Εκτίμηση των ενεργειών ενεργοποίησης για οριακή διάχυση από ελεγχόμενη ταχύτητα πυροσυσσωμάτωσης καθαρής αλουμίνας και αλουμίνας ντοπαρισμένης με ζιρκονία ή τιτάνια». Journal of the American Ceramic Society . 73 (5):1172. doi:10.1111/j.1151-2916.1990.tb05175.x




