Ονομασία ομοιοπολικών ενώσεων – Κανόνες ονοματολογίας
Μια ομοιοπολική ένωση αποτελείται από έναν συνδυασμό μη μετάλλων που συνδέονται μέσω ομοιοπολικών χημικών δεσμών. Ακολουθεί μια ματιά στους κανόνες για την ονομασία ομοιοπολικών ενώσεων και τη σύνταξη των τύπων τους.
Κανόνες για την ονομασία ομοιοπολικών ενώσεων
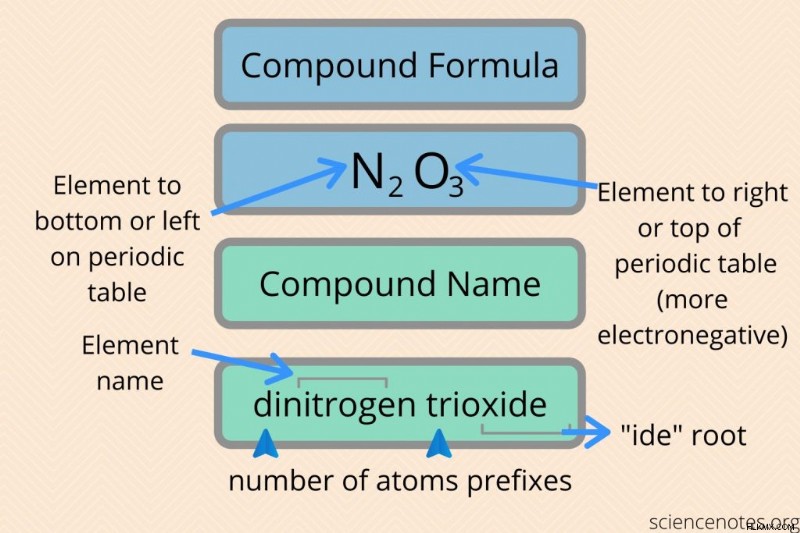
Εδώ είναι οι κανόνες για την ονομασία δυαδικών ομοιοπολικών ενώσεων. Δυαδική ένωση είναι αυτή που αποτελείται από δύο μόνο στοιχεία. Τα ονόματα ονομάζονται συστηματικά ονόματα .
- Πρώτα, ονομάστε το αμέταλλο που βρίσκεται πιο μακριά στα αριστερά και στο κάτω μέρος του περιοδικού πίνακα με το όνομα του στοιχείου του.
- Δεύτερον, ονομάστε το άλλο μη μέταλλο με το όνομα του στοιχείου του, αλλά συντομεύστε το όνομά του και προσθέστε μια κατάληξη -ide.
- Προσθέστε προθέματα (μονό-, δι-, τρι- κ.λπ.) μπροστά από το όνομα κάθε στοιχείου για να υποδείξετε τον αριθμό των ατόμων του στοιχείου. Το πρόθεμα αριθμού αντιστοιχεί στον δείκτη στον τύπο του στοιχείου. Εάν δεν υπάρχει δείκτης, σημαίνει ότι υπάρχει ένα άτομο αυτού του στοιχείου και το πρόθεμα είναι "μονο-". Ωστόσο, παραλείψτε το πρόθεμα "μονό-" στο όνομα του πρώτου στοιχείου (π.χ. CCl4 είναι τετραχλωράνθρακας και όχι τετραχλωράνθρακας).
Η επιλογή της σειράς των στοιχείων με βάση τη θέση τους στον περιοδικό πίνακα είναι η συνοπτική μέθοδος επιλογής στοιχείων με βάση την ηλεκτραρνητικότητα τους. Το στοιχείο με τη χαμηλότερη ηλεκτραρνητικότητα (ή μεγαλύτερη ηλεκτραρνητικότητα) είναι το κατιόν ή το πρώτο μέρος των ενώσεων, ενώ το στοιχείο με την υψηλότερη ηλεκτραρνητικότητα είναι το ανιόν ή το δεύτερο μέρος της ένωσης. Εάν αντιμετωπίζετε πρόβλημα με τον προσδιορισμό του κατιόντος και του ανιόντος, μπορείτε να συμβουλευτείτε μια λίστα με τιμές ηλεκτραρνητικότητας στοιχείων.
Οι κανόνες φαίνονται αρκετά απλοί, αλλά φυσικά υπάρχουν ειδικές περιπτώσεις και εξαιρέσεις. Οι δυαδικές ομοιοπολικές ενώσεις που περιέχουν οξυγόνο είναι «οξείδιο του στοιχείου», ανεξάρτητα από την ηλεκτραρνητικότητα ή τη θέση του άλλου στοιχείου στον περιοδικό πίνακα. Άρα, μια ένωση χλωρίου και οξυγόνου θα ήταν ClO2 και όχι O2 Cl, παρόλο που το οξυγόνο βρίσκεται στα αριστερά του χλωρίου στον περιοδικό πίνακα. Οι δυαδικές ενώσεις οξυγόνου και φθορίου αποτελούν την εξαίρεση. Αυτά ονομάζονται φθοριούχα οξυγόνο.
Παρόλο που το στοιχείο υδρογόνο βρίσκεται στην κορυφή του περιοδικού πίνακα, σπάνια γράφεται πρώτο σε όνομα ή τύπο ομοιοπολικής ένωσης. Εξαιρέσεις περιλαμβάνουν το νερό (H2 O) και ομοιοπολικές ενώσεις που σχηματίζονται μεταξύ υδρογόνου και αλογόνου (HCl, HBr, HI, κ.λπ.).
Επίσης, ορισμένες χημικές ουσίες είναι γνωστές με τα κοινά τους ονόματα πιο συχνά παρά με τα συστηματικά τους ονόματα. Ένα καλό παράδειγμα είναι το H2 O, που μάλλον ονομάζετε νερό και όχι μονοξείδιο του διυδρογόνου. Άλλα παραδείγματα είναι η αμμωνία (NH3 ) και το μεθάνιο (CH4 ).
Προθέματα ομοιοπολικής ένωσης
- Μην χρησιμοποιείτε το μονοπρόθεμα για το πρώτο στοιχείο ενός ονόματος.
- Ρίξτε το "o" σε μονο- ή το "a" σε τετρα-, πεντα- κ.λπ. για οξυγόνο (π.χ. μονοξείδιο όχι μονοξείδιο, πεντοξείδιο όχι πενταοξείδιο)
| Αριθμός ατόμων στην ένωση | Πρόθεμα στοιχείου |
| 1 | μονο- |
| 2 | di- |
| 3 | τρι- |
| 4 | τετρα- |
| 5 | πεντα- |
| 6 | εξα- |
| 7 | επτά- |
| 8 | οκτα- |
| 9 | nona- |
| 10 | δεκα- |
Παραδείγματα ονομάτων ομοιοπολικών ενώσεων
Για παράδειγμα:ClF3
PCl5 – πενταχλωριούχος φώσφορος
SO2 - διοξείδιο του θείου
N2 O5 – πεντοξείδιο του διζώτου
H2 O – μονοξείδιο του διυδρογόνου
CF4 – τετραφθοριούχος άνθρακας
SO3 – τριοξείδιο του θείου
ΟΧΙ2 - διοξείδιο του αζώτου
IF7 – επταφθοριούχο ιώδιο
SF6 – εξαφθοριούχο θείο
SeO – μονοξείδιο του σεληνίου
BrF5 – πενταφθοριούχο βρώμιο
CO – μονοξείδιο του άνθρακα
S2 F2 – Διφθοριούχο διθείο
Γράψιμο τύπων δυαδικών ομοιοπολικών ενώσεων
Εάν σας δοθεί το συστηματικό όνομα μιας δυαδικής ομοιοπολικής ένωσης, χρησιμοποιήστε τους ίδιους κανόνες για να γράψετε τον μοριακό τύπο . Απλώς θυμηθείτε ότι εάν λείπει ένα πρόθεμα, σημαίνει ότι υπάρχει μόνο ένα άτομο του στοιχείου. Παραλείψτε τον δείκτη (π.χ. H2 O όχι H2 O1 ). Εάν είναι απαραίτητο, ελέγξτε τα σύμβολα των στοιχείων.
Φύλλο εργασίας ιοντικής και ομοιοπολικής ένωσης

Ελέγξτε πόσο καλά κατανοείτε τις ομοιοπολικές ενώσεις χρησιμοποιώντας ένα φύλλο εργασίας. Κατεβάστε και εκτυπώστε αυτό το φύλλο εργασίας PDF και το κλειδί απάντησης. Δώστε τα ονόματα των ενώσεων και προσδιορίστε αν είναι ιοντικές ή ομοιοπολικές.
[Φύλλο εργασίας PDF ] [Κλειδί απάντησης ]
Αναφορές
- Campbell, Neil A.; Williamson, Brad; Heyden, Robin J. (2006). Βιολογία:Εξερευνώντας τη ζωή . Βοστώνη, MA:Pearson Prentice Hall. ISBN 0-13-250882-6.
- IUPAC. 1993. Οδηγός για την ονοματολογία IUPAC των οργανικών ενώσεων (το «Μπλε Βιβλίο»). Oxford:Blackwell Scientific Publications. ISBN 0-632-03488-2.
- Rigaudy, J.; Klesney, S. P., eds. (1979). Ονοματολογία Οργανικής Χημείας . IUPAC/Pergamon Press. ISBN0-08022-3699 .




