Ορισμός και λίστα σημείου τήξης

Το σημείο τήξης είναι η θερμοκρασία στην οποία μια ουσία αλλάζει από στερεή σε υγρή. Στο σημείο τήξης, η στερεή και η υγρή κατάσταση υπάρχουν και βρίσκονται σε ισορροπία. Το σημείο τήξης είναι μια φυσική ιδιότητα της ύλης.
Ακολουθεί μια ματιά στους παράγοντες που επηρεάζουν το σημείο τήξης, πώς διαφέρει το σημείο τήξης από το σημείο πήξης και πίνακες τιμών σημείου τήξης στοιχείων και άλλων ουσιών.
Παράγοντες που επηρεάζουν το σημείο τήξης
Η πίεση είναι ο πρωταρχικός παράγοντας που επηρεάζει το σημείο τήξης. Για το λόγο αυτό, τα σημεία τήξης συνήθως περιλαμβάνουν τιμές πίεσης. Ουσίες με υψηλά σημεία τήξης έχουν ισχυρές διαμοριακές δυνάμεις που δεσμεύουν άτομα ή μόρια μεταξύ τους και κατά συνέπεια χαμηλές πιέσεις ατμών. Για παράδειγμα, το νερό έχει υψηλότερο σημείο τήξης από συγκρίσιμες ενώσεις, επειδή ο δεσμός υδρογόνου βοηθά τον πάγο να διατηρήσει τη δομή του. Οι ιοντικές ενώσεις έχουν γενικά υψηλότερα σημεία τήξης από τις ομοιοπολικές ενώσεις επειδή οι ιοντικοί δεσμοί είναι ισχυρότεροι από τους ομοιοπολικούς δεσμούς.
Διαφορά μεταξύ σημείου τήξης και σημείου πήξης
Η κατάψυξη είναι η αντίστροφη διαδικασία τήξης όπου μια ουσία αλλάζει κατάσταση από υγρή σε στερεή. Μπορεί να νομίζετε ότι το σημείο τήξης και το σημείο πήξης είναι η ίδια θερμοκρασία. Συνήθως, οι δύο τιμές είναι αρκετά κοντά ώστε να είναι ουσιαστικά ίδιες. Όμως, μερικές φορές το σημείο πήξης είναι χαμηλότερο από το σημείο τήξης λόγω υπερψύξης. Ένα υπερψυγμένο υγρό δεν στερεοποιείται επειδή δεν έχει θέσεις πυρήνων που επιτρέπουν το σχηματισμό κρυστάλλων. Ουσιαστικά, η υγρή του κατάσταση είναι πιο σταθερή από τη στερεά του, ακόμη και κάτω από το σημείο τήξης του.
Η υπερψύξη συμβαίνει με το νερό. Το σημείο τήξης του πάγου είναι 0 °C (32 °F ή 273,15 K), αλλά το σημείο πήξης του νερού μπορεί να φτάσει έως τους -40 °C ή -40 °F!
Το σημείο πήξης εξαρτάται επίσης από την καθαρότητα. Οι ακάθαρτες ουσίες παρουσιάζουν κατάθλιψη σημείου πήξης. Και εδώ, το σημείο πήξης μπορεί να είναι χαμηλότερο από το σημείο τήξης.
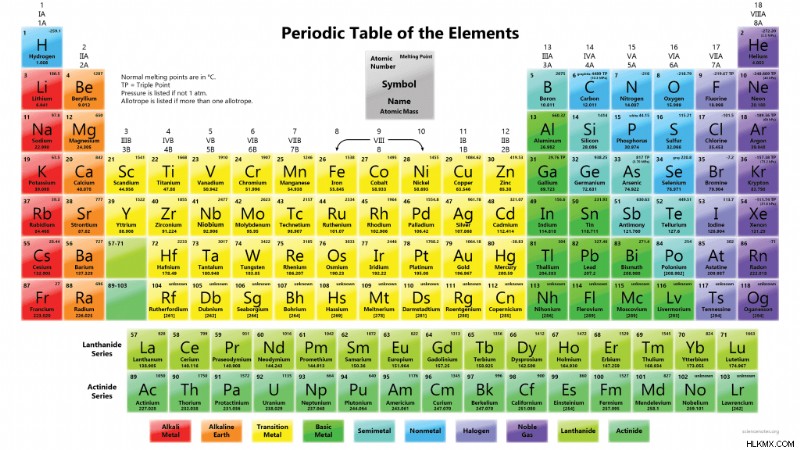
Σημεία τήξης των στοιχείων
Το στοιχείο με το υψηλότερο σημείο τήξης είναι το βολφράμιο, με σημείο τήξης 3.414 °C (6.177 °F, 3.687 K). Το βολφράμιο είναι ένα μεταβατικό μέταλλο. Πολλές αναφορές αναφέρουν τον άνθρακα ως το στοιχείο με το υψηλότερο σημείο τήξης (3642 °C, 6588 °F, 3915 K), αλλά ο άνθρακας στην πραγματικότητα εξαχνώνεται από ένα στερεό απευθείας σε ένα αέριο σε συνηθισμένες πιέσεις. Είναι μόνο σε υγρό σε υψηλές πιέσεις (10 MPa ή 99 atm). Υπό αυτές τις ακραίες συνθήκες, εκτιμάται ότι ο άνθρακας έχει σημείο τήξης 4.030–4.430 °C (7.290–8.010 °F, 4.300–4.700 K).
Το στοιχείο με το χαμηλότερο σημείο τήξης είναι το ήλιο, με σημείο τήξης 0,95 K (−272,20 °C, −457,96 °F) σε πίεση 2,5 MPa. Αυτό είναι πολύ κοντά στο απόλυτο μηδέν. Το μέταλλο με το χαμηλότερο σημείο τήξης είναι ο υδράργυρος, με σημείο τήξης 234,3210 K (−38,8290 °C, −37,8922 °F). Ο υδράργυρος είναι ένα υγρό σε θερμοκρασία δωματίου.
Γενικά, τα μέταλλα τείνουν να έχουν υψηλά σημεία τήξης και βρασμού. Τα μη μέταλλα έχουν συνήθως σχετικά χαμηλά σημεία τήξης και βρασμού.
Πίνακας τιμών σημείου τήξης για παραδείγματα ουσιών
Η ουσία με το υψηλότερο γνωστό σημείο τήξης είναι το καρβίδιο του τανταλίου άφνιο (Ta4 HfC5 ) . Το καρβίδιο του τανταλίου είναι ένα πυρίμαχο μέταλλο με σημείο τήξης 4.215 K (3.942 °C, 7.127 °F). Τα μοντέλα υπολογιστών προβλέπουν το κράμα HfN0,38 C0,51 έχει ακόμη υψηλό σημείο τήξης περίπου 4400 K.
| Χημικό | Σημείο τήξης (K) |
| Ήλιο | Δεν λιώνει σε κανονική πίεση |
| Άνθρακας | Δεν λιώνει σε κανονική πίεση |
| Υδρογόνο | 14.01 |
| Οξυγόνο | 54,36 |
| Χλώριο | 171,6 |
| Ερμής | 234,4 |
| Νερό | 273 |
| Γάλλιο | 302,9 |
| Βούτυρο κακάο | 307.2 |
| Κερί παραφίνης | 310 |
| Κάλιο | 336,5 |
| Ιώδιο | 386,9 |
| Συγκόλληση μολύβδου | 456 |
| Προηγούμενος | 600,6 |
| Ασημί | 1234,9 |
| Χρυσός | 1337.3 |
| Χαλκός | 1357.8 |
| Σίδερο | 1811 |
| Βολφράμιο | 3695 |
Πώς μετράται το σημείο τήξης
Όταν μια ουσία λιώνει το στερεό της μετατρέπεται σε υγρό. Η αλλαγή φάσης είναι ενδόθερμη επειδή οι χημικοί δεσμοί απορροφούν ενέργεια για να σπάσουν την άκαμπτη δομή τους και να αλλάξουν από στερεό σε υγρό. Έτσι, η μέτρηση του σημείου τήξης λειτουργεί με έναν από τους δύο τρόπους:
- Αυξήστε αργά τη θερμοκρασία ενός στερεού και παρακολουθήστε τον σχηματισμό υγρού.
- Θερμάνετε ένα υλικό και παρακολουθήστε τη θερμοκρασία του μαύρου σώματος του με ένα πυρόμετρο.
Αναφορές
- Agte, C.; Alterthum, Η. (1930). «Έρευνες σε συστήματα με καρβίδια σε υψηλό σημείο τήξης και συμβολές στο πρόβλημα της σύντηξης άνθρακα». Ζ. Τεχν. Phys . 11:182–191.
- Haynes, William M., ed. (2011). CRC Handbook of Chemistry and Physics (92η έκδ.). Τύπος CRC. ISBN 1439855110.
- Hong, Q.-J.; van de Walle, A. (2015). «Πρόβλεψη του υλικού με το υψηλότερο γνωστό σημείο τήξης από εξαρχής υπολογισμούς μοριακής δυναμικής». Φυσ. Σεβ. Β . 92 (2):020104 (R). doi:10.1103/PhysRevB.92.020104
- Ramsay, J. A. (1949). «Μια νέα μέθοδος προσδιορισμού του σημείου πήξης για μικρές ποσότητες». J. Exp. Biol . 26 (1):57–64.




