Ακετόνη (CH3COCH3) – Δομή, Ιδιότητες, Παρασκευή, Χρήσεις
Τι είναι η ακετόνη; Η ακετόνη είναι μια οργανική ένωση που είναι πολύ εύφλεκτη και έχει χημικό τύπο C3 H6 Ο. Το άλλο όνομα της ακετόνης είναι προπανόνη. Παράγεται στα καυσαέρια φυτών, οχημάτων, δασικών πυρκαγιών και δέντρων. Παράγεται επίσης στο ανθρώπινο σώμα και βρίσκεται στο αίμα και στα ούρα. Η ακετόνη είναι μια άχρωμη πτητική ένωση που είναι αναμίξιμη με αιθανόλη, νερό και αιθέρα. Έχει πικάντικη ή ερεθιστική οσμή και έχει ευρείες εφαρμογές ως διαλύτης ή αντισηπτικό. Εάν θέλετε να μάθετε περισσότερα για το τι είναι το ασετόν, διαβάστε παρακάτω!
Η ακετόνη παρήχθη για πρώτη φορά από αλχημιστές με ξηρή απόσταξη οξικών μετάλλων. Σήμερα, η ακετόνη παρασκευάζεται από προπυλένιο είτε άμεσα είτε έμμεσα. Περίπου το 80% της ακετόνης παρασκευάζεται σε μια διαδικασία που ονομάζεται διαδικασία κουμένιου. Επίσης, υπάρχουν κάποιες παλαιότερες μέθοδοι παρασκευής κουμένιου.
Δομή Ακετόνης
Ακολουθεί μια αναπαράσταση της δομής της ακετόνης:
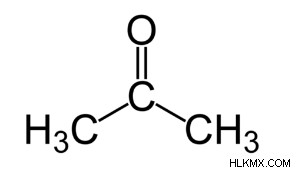
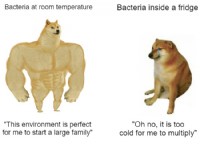
Ο τύπος ακετόνης είναι C3 H6 O ή CH3COCH3. Είναι η απλούστερη γνωστή κετόνη με έξι άτομα υδρογόνου, τρία άτομα άνθρακα και ένα άτομο οξυγόνου. Δύο ομάδες μεθυλίου συνδέονται με το μεσαίο άτομο άνθρακα στα άτομα της ένωσης ακετόνης. Αυτό το άτομο άνθρακα σχηματίζει επίσης διπλό δεσμό με ένα άτομο οξυγόνου σχηματίζοντας μια λειτουργική ομάδα κετόνης ή καρβονυλίου. Στη δομή της ακετόνης, υπάρχουν δύο διαθέσιμα σθένη, τα οποία και τα δύο συνδέονται με άτομα άνθρακα. Έτσι, η κετο ομάδα στην ένωση υπάρχει εντός μιας αλυσίδας.
Παρασκευή ακετόνης
Περίπου το 80% της ακετόνης στις βιομηχανίες παράγεται με μια διαδικασία γνωστή ως διαδικασία κουμένιου. Εδώ, το κουμένιο παράγεται με αλκυλίωση του βενζολίου με προπυλένιο και στη συνέχεια οξειδώνεται από τον αέρα για να δώσει ακετόνη και φαινόλη.
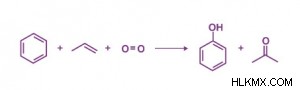
Παραγωγή ακετόνης
- Στη βιομηχανία, η ακετόνη μπορεί να παραχθεί από ισοπροπανόλη με καταλυτική αφυδρογόνωση με οξείδιο ψευδαργύρου ή χαλκό. Μπορεί επίσης να παραχθεί εάν ο καταλύτης αργύρου οξειδωθεί καταλυτικά.
- Η ακετόνη λαμβάνεται με διοχέτευση ενός μίγματος οξυγόνου και προπανίου υπό πίεση σε ένα υδατικό διάλυμα χλωριούχου χαλκού και παλλαδίου.
- Παράγεται από την οξείδωση του φυσικού αερίου.
- Από όλες τις διεργασίες, η πιο σημαντική για την παραγωγή 2-προπανόνης και φαινόλης είναι η διαδικασία κουμενίου φαινόλης. Εκτελείται με την οξείδωση του κουμενίου για να δώσει το υδροϋπεροξείδιο του. Αυτό το υδροϋπεροξείδιο στη συνέχεια αποσυντίθεται από αραιό θειικό οξύ για να δώσει 2-προπανόλη και φαινόλη.
Γενικές ιδιότητες της ακετόνης – C3 H6 O
Φυσικές ιδιότητες της ακετόνης
| Μοριακή μάζα ακετόνης | Η μοριακή μάζα ακετόνης είναι 58,08 g·mol−1 |
| Εμφάνιση | Άχρωμο υγρό σε θερμοκρασία δωματίου |
| Οσμή | Πυριτικό ή ερεθιστικό |
| Σημείο τήξης | −94,6 °C (−138,5 °F, 178,5 K) |
| Πυκνότητα | 0,7846 g/ ㎤ |
| Σημείο βρασμού | 56,04 °C (132,89 °F; 329,20 K) |
| Μαγνητική επιδεκτικότητα (χ) | −33,78·10−6 ㎤/mol |
| Διαλυτότητα στο νερό | Αναμίξιμο |
| Διαλυτότητα σε άλλα υγρά | Αναμίξιμο σε διαιθυλαιθέρα, αιθανόλη, βενζόλιο, μεθανόλη και χλωροφόρμιο |
| Δείκτης διάθλασης (nD) | 1.3588 |
| Ιξώδες | 0,295 mPa·s (25 °C) |
| Φόρμουλα ακετόνης | C3 H6 O |
Χημικές ιδιότητες της ακετόνης
Κετο/ενόλη Ταυτομερισμός:
Η ακετόνη παρουσιάζει ταυτομερισμό της κετοενόλης, η οποία είναι μια από τις σημαντικότερες χημικές της ιδιότητες. Αρκετά μόρια που περιέχουν την ομάδα -καρβονυλίου εμφανίζουν μια ισορροπία μεταφοράς πρωτονίων γνωστή ως ταυτομερισμό λόγω της οξύτητας των α-υδρογόνων. Τα ταυτομερή είναι συνταγματικά ισομερή εύκολα αλληλομετατρέψιμα και διαφοροποιούνται από διαφορετική θέση για ένα άτομο ή μια ομάδα.
Καθώς υπάρχει μια αναδιάταξη των ατόμων στα ταυτομερή, είναι αρκετά διαφορετικά από τις μορφές συντονισμού στις οποίες η μόνη διαφορά είναι στη θέση των ηλεκτρονίων ή των δεσμών του μοναχικού ζεύγους. Στον όρο ταυτομερισμός κετο/ενόλης, το «κετο» υποδηλώνει ότι το ταυτομερές περιλαμβάνει έναν καρβονυλικό δεσμό, ενώ το «ενόλη» υποδηλώνει την παρουσία μιας ομάδας υδροξυλίου ή ενός διπλού δεσμού.
Το σημείο ισορροπίας στον ταυτομερισμό κετο-ενόλης εξαρτάται από τους παράγοντες σταθεροποίησης τόσο του ταυτομερούς κετο-ενόλης. Υπό κανονικές συνθήκες για απλές καρβονυλικές ενώσεις, η ισορροπία συνήθως ευνοεί έντονα το κετο ταυτομερές. Προτιμάται επειδή το ταυτομερές κετο είναι πιο σταθερό από το ταυτομερές ενόλη κατά περίπου 46-59 kJ/mol. Η σταθερότητα οφείλεται επίσης στο γεγονός ότι ο διπλός δεσμός C=O είναι πιο σταθερός και ισχυρότερος από τον διπλό δεσμό C=C.
Επίσης, οι κετόνες περιέχουν δύο ομάδες αλκυλίου που δίνουν ηλεκτρόνια στον άνθρακα της καρβονυλικής ομάδας. Ως εκ τούτου, η σταθερότητά τους είναι υψηλή και είναι λιγότερο πιθανό να σχηματίσουν το ταυτομερές ενόλη σε σύγκριση με τις αλδεΰδες. Για παράδειγμα, η προπανάλη είναι χιλιάδες φορές πιο κατάλληλη να βρίσκεται στο ταυτομερές της ενόλης από την ακετόνη. Με τα παράγωγα του καρβοξυλικού οξέος, το καρβονύλιο σταθεροποιείται από την ομάδα που φεύγει μέσω της δωρεάς ηλεκτρονίων, καθιστώντας την παραγωγή ταυτομερούς ενόλης πολύ λιγότερο δυνατή. Γενικά, οι κετόνες έχουν 100.000.000 φορές μεγαλύτερη πιθανότητα να βρίσκονται σε μορφή ταυτομερούς ενόλης από τους εστέρες. Παρακάτω είναι μια αναπαράσταση του κετο-ταυτομερισμού που φαίνεται από την ακετόνη:

Αντίδραση αλοφορμίου
Καθώς η ακετόνη περιέχει το CH3 -Ομάδα C=O, παρουσιάζει αντίδραση αλοφορμίου, που σημαίνει ότι αντιδρά με αλογόνα για να δώσει όξινο άλας και αλογονοφόρμιο παρουσία αλκαλίου.
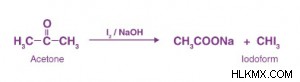
Μηχανισμός αντίδρασης αλοφορμίου
Ακολουθεί μια βήμα προς βήμα εξήγηση της αντίδρασης αλοφορμίου:
Βήμα 1
Το άλφα υδρογόνο αφαιρείται από τη βάση (ιόν υδροξειδίου) για να παραχθεί ένα ενολικό. Μετά από αυτό, εμφανίζεται η αντίδραση μεταξύ αλογόνου και ενολικού, η οποία οδηγεί στο σχηματισμό μιας αλογονωμένης κετόνης επιπλέον ενός ανιόντος που αντιστοιχεί στο αλογόνο.
Βήμα 2
Υπάρχει μια επανάληψη του βήματος 1 δύο φορές για να δώσει μια τρι-αλογονωμένη κετόνη.
Βήμα 3
Το ιόν υδροξειδίου λειτουργεί ως πυρηνόφιλο και προσβάλλει τον διπλά συνδεδεμένο ηλεκτροφιλικό άνθρακα. Ο διπλός δεσμός είναι μεταξύ άνθρακα και οξυγόνου. Μετά την αντίδραση, μεταβάλλεται σε έναν μόνο δεσμό, καθιστώντας το άτομο οξυγόνου ανιονικό. Αυτό ευνοεί την αναμόρφωση του διπλού δεσμού άνθρακα-οξυγόνου, και υπάρχει μια μετατόπιση του άνθρακα που συνδέεται με τρία αλογόνα, και η καρβοξυλική ομάδα αφήνεται. Μετά από αυτό, λαμβάνει χώρα μια αντίδραση οξέος-βάσης, υπάρχει μια δωρεά ενός πρωτονίου από το καρβοξυλικό οξύ στο ανιόν τρι-αλομεθυλίου και λαμβάνεται το απαιτούμενο προϊόν αλογονοφορμίου.
Χρήσεις ακετόνης
Η ακετόνη έχει ευρείες εφαρμογές στην κλωστοϋφαντουργική και φαρμακευτική βιομηχανία, στα εργαστήρια και στην κατασκευή εγχώριων προϊόντων καθημερινής χρήσης. Χρησιμοποιείται επίσης στην κατασκευή μεθακρυλικού μεθυλεστέρα και μεθυλ ισοβουτυλοκετόνης. Η ακετόνη έχει επίσης ευρείες εφαρμογές στους τομείς της χημικής έρευνας και της αναλυτικής βιομηχανίας.
Χρησιμοποιείται ως διαλύτης: Η ακετόνη χρησιμοποιείται ως διαλύτης για κυτταρίνη, λάκες, ακετυλένιο και οξική κυτταρίνη. Λειτουργεί ως εξαιρετικός διαλύτης για ορισμένα πλαστικά και συνθετικές ίνες που χρησιμοποιούνται στην κατασκευή πολυεστερικής ρητίνης. Χρησιμοποιείται επίσης στην κατασκευή βερνικιών και χρωμάτων.
Χρήσεις στην ιατρική: Η ακετόνη χρησιμοποιείται ως διαλύτης στην παρασκευή φαρμάκων για την εξασφάλιση της ακριβούς δοσολογίας τους. Χρησιμοποιείται επίσης στην απολύμανση και αποστείρωση ιατρικών εργαλείων και εξοπλισμού. Οι δερματολόγοι χρησιμοποιούν ασετόν για να αντιμετωπίσουν την ακμή που υπάρχει στο δέρμα που ξεφλουδίζει.
Οικιακές χρήσεις ακετόνης: Το ασετόν έχει πολλές εγχώριες εφαρμογές. Χρησιμοποιείται ως πρόσθετο σε κρέμες δέρματος και μακιγιάζ, είναι το κύριο συστατικό της σούπερ κόλλας και αφαίρεσης βαφής νυχιών και χρησιμοποιείται για την εκτύπωση αντικειμένων σε πλαστικό ABC και τρισδιάστατα τυπωμένα μοντέλα. Το ασετόν χρησιμοποιείται σε προϊόντα καθαρισμού που προορίζονται για τον καθαρισμό ηλεκτρονικών συσκευών και μικροσυσκευών.
Συμπέρασμα
Ελπίζουμε ότι αυτό το άρθρο θα σας βοηθήσει να αποκτήσετε μια θεμελιώδη κατανόηση της δομής της ακετόνης, του τύπου ακετόνης, της μοριακής μάζας ακετόνης, του τι είναι η ακετόνη, ποιες είναι οι φυσικές και χημικές της ιδιότητες, ποιες είναι οι εφαρμογές της και πώς παρασκευάζεται στο εργαστήριο. Ελπίζουμε ότι μέχρι το τέλος, θα είστε σε θέση να απαντήσετε στις περισσότερες ερωτήσεις σχετικά με αυτό το θέμα.
Συχνές ερωτήσεις
1. Ποιες είναι οι χρήσεις της ακετόνης στον τομέα της χημικής έρευνας;
Α. Η ακετόνη χρησιμοποιείται στο εργαστήριο σε ένα ευρύ φάσμα οργανικών χημικών αντιδράσεων με τη μορφή πολικού διαλύτη. Καθώς είναι οικονομικά αποδοτικό και έχει χαμηλή πτητικότητα, χρησιμοποιείται ως κοινός διαλύτης για τον καθαρισμό εργαστηριακού εξοπλισμού. Η ακετόνη χρησιμοποιείται επίσης στο εργαστήριο χημικής έρευνας για την καθίζηση πρωτεϊνών.
2. Ποιες είναι οι χρήσεις της ακετόνης στον τομέα της αναλυτικής βιομηχανίας;
Α. Στον τομέα της αναλυτικής βιομηχανίας, η ακετόνη χρησιμοποιείται στη χρωματογραφική έρευνα ως καλός διαλύτης χρωστικής. Χρησιμοποιείται επίσης σε αέρια χρωματογραφία, χρωματογραφία λεπτής στοιβάδας και υγρή χρωματογραφία υψηλής απόδοσης λόγω της υψηλής διαλυτότητάς του.
3. Μπορεί το ασετόν να χρησιμοποιηθεί ως αφαίρεση βερνικιού νυχιών;
Α. Επειδή η ακετόνη είναι ισχυρός διαλύτης, χρησιμοποιείται ως αφαίρεση βαφής νυχιών. Επιπλέον, μπορεί να χρησιμοποιηθεί και ως σούπερ αφαίρεση κόλλας. Χρησιμοποιείται επίσης αποτελεσματικά για την προετοιμασία βαφών νυχιών και την αφαίρεση διαφορετικών τύπων ελαίων.
4. Είναι η ακετόνη τοξική;
Α. Η εισπνοή ακετόνης σε μέτριες έως υψηλές ποσότητες για ένα χρονικό διάστημα μπορεί να οδηγήσει σε ερεθισμό της μύτης, των πνευμόνων, του λαιμού και των ματιών. Μπορεί επίσης να οδηγήσει σε ζάλη, πονοκεφάλους, γρήγορο σφυγμό, σύγχυση, έμετο, ναυτία, απώλεια των αισθήσεων, επιδράσεις στο αίμα, αλλαγές στους εμμηνορροϊκούς κύκλους στις γυναίκες και στη χειρότερη περίπτωση, κώμα.