Διχρωμικό Κάλιο – Τύπος, Δομή, Παρασκευή, Ιδιότητες &Χρήσεις
Μια ένωση χρωμίου και ένα από τα πιο δημοφιλή χημικά αντιδραστήρια στην οργανική χημεία, το διχρωμικό κάλιο χρησιμεύει ως ισχυρός οξειδωτικός παράγοντας. Βοηθά στην πραγματοποίηση διαφόρων χημικών αντιδράσεων όπου η οξείδωση εμπλέκεται σε εμπορικά και εργαστηριακά περιβάλλοντα. Ο χειρισμός της ένωσης γίνεται με τη μέγιστη προσοχή, επειδή ακόμη και μια ελαφρά απροσεξία μπορεί να οδηγήσει σε κινδύνους από το διχρωμικό κάλιο.
Εμφάνιση διχρωμικού καλίου
Το διχρωμικό κάλιο εμφανίζεται φυσικά με τη μορφή ενός σπάνιου ορυκτού που ονομάζεται λοπεζίτης. Λαμβάνεται ως γεμίσματα vug στα κοιτάσματα νιτρικών της ερήμου Atacama στη Χιλή καθώς και στο πυριγενές σύμπλεγμα Bushveld στη Νότια Αφρική.
Τύπος διχρωμικού καλίου
Είναι ένα άλας δικαλίου του διχρωμικού οξέος. Περιέχει τα ακόλουθα στοιχεία:
- Κάλιο
- Chromium
- Οξυγόνο
Ο τύπος διχρωμικού καλίου είναι K2 Cr2 O7 . Το όνομα IUPAC του K2 Cr2 O7 είναι το διχρωμικό κάλιο (VI). Τα άλλα ονόματα της ένωσης είναι τα εξής:
- Διχρωμικό κάλιο
- Διχρωμικό κάλιο
- Διχρωμικό άλας ποτάσας
- Χρωμικό οξύ, άλας δικαλίου
Δομή διχρωμικού καλίου
Είναι μια ιοντική ένωση που περιέχει δύο κατιόντα καλίου και ένα αρνητικά φορτισμένο διχρωμικό ανιόν. Το διχρωμικό έχει δύο εξασθενή άτομα χρωμίου (με κατάσταση οξείδωσης 6+) και είναι συνδεδεμένα με άτομα οξυγόνου.
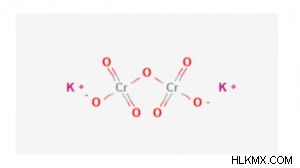
Δομή Διχρωμικού Καλίου
Περιέχει δύο ιοντικούς δεσμούς μεταξύ δύο κατιόντων καλίου και ενός διχρωμικού ανιόντος. Το διχρωμικό ανιόν έχει αρκετούς ομοιοπολικούς δεσμούς, καθώς κάθε χρώμιο συνδέεται με τέσσερα άτομα οξυγόνου.
Παρασκευή διχρωμικού καλίου
Εδώ είναι μια βήμα προς βήμα παρασκευή του διχρωμικού καλίου. Τα ακόλουθα βήματα και οι χημικές εξισώσεις απεικονίζουν τις αλλαγές που οδηγούν στον σχηματισμό διχρωμικού καλίου.
Βήμα 1: Επεξεργασία σιδηρομεταλλεύματος χρωμίου και μετατροπή σε χρωμικό νάτριο
Αρχικά, το μετάλλευμα μετατρέπεται σε μορφή σκόνης. Στη συνέχεια, το μείγμα του παρασκευάζεται με ανθρακικό νάτριο και άσβεστο ή οξείδιο του ασβεστίου. Το μείγμα στη συνέχεια θερμαίνεται σε υψηλές θερμοκρασίες σε κλίβανο αντηχήσεως με άφθονη παροχή αέρα. Πραγματοποιείται η ακόλουθη αντίδραση:
4 FeO.Cr2 O3 + 8 Na2 CO3 + 7 O2 → 8 Na2 CrO4 + 2 Fe2 O3 + 8 CO2
Βήμα 2: Μετατροπή Na2 CrO4 προς Na2 Cr2 O7
Το πρώτο βήμα δίνει διάλυμα χρωμικού νατρίου. Στο δεύτερο βήμα, καθαρίζεται και φιλτράρεται για να αφαιρεθεί το οξείδιο του σιδήρου και οι ακαθαρσίες.
Στη συνέχεια, το χρωμικό νάτριο αντιδρά με πυκνό θειικό οξύ, το οποίο μετατρέπει το χρωμικό νάτριο σε διχρωμικό νάτριο.
2 Na2 CrO4 + H2 SO4 → Na2 Cr2 O7 + Na2 SO4 + H2 O
Βήμα 3: Μετατροπή διχρωμικού νατρίου και διχρωμικού καλίου
Το τελευταίο βήμα περιλαμβάνει τη μετατροπή του διχρωμικού νατρίου σε διχρωμικό κάλιο. Ένα θερμό πυκνό διάλυμα διχρωμικού νατρίου αντιδρά με χλωριούχο κάλιο για να δώσει την επιθυμητή ένωση. Η αντίδραση προχωρά ως εξής:
Na2 Cr2 O7 + 2 KCl → K2 Cr2 O7 + 2 NaCl
Σε αντίθεση με το χλωριούχο νάτριο, το διχρωμικό κάλιο είναι ελάχιστα διαλυτό στο νερό. Έτσι, διαχωρίζεται με τη μορφή κρυστάλλων όταν το διάλυμα ψύχεται.
Ιδιότητες του διχρωμικού καλίου
Η σύνθεση έχει ένα εντυπωσιακά όμορφο έντονο κόκκινο-πορτοκαλί χρώμα. Εμφανίζεται σε ιοντική στερεά κρυσταλλική κατάσταση. Ένας από τους κύριους λόγους για τους οποίους το διχρωμικό κάλιο χρησιμοποιείται ευρέως στη χημεία είναι η μη λιπαντική του ουσία. Σε αντίθεση με άλλα άλατα όπως το διχρωμικό νάτριο, δεν διαλύεται εύκολα όταν απορροφά την υγρασία. Εδώ είναι μερικές από τις βασικές ιδιότητες του διχρωμικού καλίου:
- Εμφάνιση:Κόκκινο-πορτοκαλί κρυσταλλικό στερεό
- Μοριακή μάζα διχρωμικού καλίου:294,185 g/mol
- Οσμή:Άοσμη
- Σημείο τήξεως:398 °C (748 °F, 671 K)
- Πυκνότητα:2,676 g/cm3, στερεό
- Σημείο βρασμού:500 °C (932 °F, 773 K) αποσυντίθεται.
- Διαλυτότητα:Αδιάλυτο σε αλκοόλη, ακετόνη
- Διαλυτότητα στο νερό:4,9 g/100 mL (0 °C)
- Κατάσταση:στερεό σε θερμοκρασία δωματίου.
- Κύση:άκαυστη
- Φύση:εξαιρετικά διαβρωτικό.
- Δείκτης διάθλασης:1,738
- Η γεωμετρία του κεντρικού ατόμου χρωμίου:τετραεδρικό.
Χημικές ιδιότητες του διχρωμικού καλίου
Ακολουθούν μερικές από τις χημικές αντιδράσεις που απεικονίζουν πώς αντιδρά το διχρωμικό κάλιο με τη θερμότητα, τα μέταλλα, τα αλκάλια και άλλα.
Σε θέρμανση
Το διχρωμικό κάλιο αποσυντίθεται όταν θερμαίνεται. Απελευθερώνει χρωμικό κάλιο και οξυγόνο. Η ισορροπημένη αντίδραση απεικόνισε τις αλλαγές:
4 K2 Cr2 O7 → 4 K2 CrO4 + 2 Cr2 O3 + 3 O2
Αντίδραση με αλκάλια
Έχει μια ενδιαφέρουσα αντίδραση με τα αλκάλια. Το πορτοκαλοκόκκινο χρώμα του διαλύματος γίνεται κίτρινο όταν αντιδρά με αλκάλια. Το κίτρινο χρώμα αντιπροσωπεύει το σχηματισμό χρωμικού καλίου. Η χημική αντίδραση για το ίδιο προχωρά ως εξής:
K2 Cr2 O7 + 2 KOH → 2 K2 CrO4 + H2 O
Πορτοκαλοκόκκινο Κίτρινο
Επίσης, το κίτρινο χρώμα του K2 CrO4 μπορεί να μετατραπεί σε πορτοκαλοκόκκινο χρώμα εάν οξινιστεί λόγω του σχηματισμού του K2 Cr2 O7 . Πραγματοποιείται η ακόλουθη αντίδραση:
2 K2 CrO4 + H2 SO4 → K2 Cr2 O7 + K2 SO4 + H2 O
Πορτοκαλοκόκκινο Κίτρινο
Αντιδράσεις οξείδωσης
- Το διχρωμικό κάλιο είναι ένας ισχυρός οξειδωτικός παράγοντας ως ένα από τα K2 Cr2 O7 παράγει τρία moles οξυγόνου όταν αντιδρά με αραιό H2 SO4 . Η αντίδραση μπορεί να συνοψιστεί ως εξής:
K2 Cr2 O7 + 4 H2 SO4 → K2 SO4 + Cr2 (SO4 )3 + 4 H2 O + 3(O)
- Απελευθερώνει ιώδιο όταν αντιδρά με KI όπως φαίνεται παρακάτω:
K2 Cr2 O7 + 7 H2 SO4 + 6 KI → 4 K2 SO4 + Cr2 (SO4 )3 + 3 I2 + 7 H2 O
- Το άλας σιδήρου λαμβάνεται όταν το διχρωμικό κάλιο οξειδώνει τα άλατα σιδήρου. Η ισορροπημένη εξίσωση για αυτήν την αντίδραση δίνεται παρακάτω:
K2 Cr2 O7 + 7 H2 SO4 + 6 FeSO4 → K2 SO4 + Cr2 (SO4 )3 + 3 Fe2 (SO4 )3 + 2 H2 O
- Οξειδώνει το υδρόθειο σε θείο ως εξής:
K2 Cr2 O7 + 4 H2 SO4 + 3 H2 S → K2 SO4 + Cr2 (SO4 )3 + 7 H2 O + 3 S
Δοκιμή Chromyl Chloride
Η δοκιμή χρωμυλοχλωριδίου είναι μια δημοφιλής εργαστηριακή δοκιμή για άλατα που περιέχουν χλωρίδιο (ιόντα χλωρίου). Σε αυτή τη δοκιμή, το διχρωμικό κάλιο και το πυκνό θειικό οξύ αντιδρούν με χλωριούχα άλατα για να δώσουν χλωριούχο χρωμύλιο το οποίο έχει τη μορφή καστανέρυθρων ατμών. Η εξίσωση για την αντίδραση είναι η εξής:
K2 Cr2 O7 + 4 KCl + 6 H2 SO4 → 2 CrO2 Cl2 + 6 KHSO4 + 3 H2 O
Χρήσεις διχρωμικού καλίου
Ακολουθούν οι βασικές χρήσεις του διχρωμικού καλίου:
- Το διχρωμικό κάλιο χρησιμοποιείται συνήθως στην παραγωγή στυπτηρίας χρωμίου καλίου και χρησιμοποιείται επίσης στη βιομηχανία βυρσοδεψίας δέρματος.
- Αυτή η χημική ένωση χρησιμοποιείται ως πρώτη ύλη για την παρασκευή χρωμικού οξέος. Το χρωμικό οξύ, με τη σειρά του, χρησιμοποιείται για τον καθαρισμό γυάλινων σκευών και δρα ως χαρακτικό για γυάλινα σκεύη. Ωστόσο, η χρήση του έχει περιοριστεί πολύ, λόγω της επικίνδυνης φύσης του.
- Αυτή η χημική ένωση είναι σκληρυντικός παράγοντας για οργανικούς διαλύτες όπως βαφή, αιθάλη, ζελατίνη και αραβικό κόμμι. Οι σκληρυμένοι διαλύτες χρησιμοποιούνται στην παραγωγή μεταλλικών πλακών εκτύπωσης που βρίσκουν τη χρήση τους σε διαδικασίες φωτομηχανικής εκτύπωσης.
- Η κατασκευαστική βιομηχανία το χρησιμοποιεί σε τσιμεντόλιθους καθώς αυξάνει τον χρόνο στερεοποίησης του μίγματος σκυροδέματος, βελτιώνοντας έτσι την πυκνότητα και το χρώμα του. Αν και η μακροχρόνια έκθεσή του στο δέρμα προκαλεί δερματικές παθήσεις στους εργάτες των κατασκευών.
- Η βιομηχανία φωτογραφίας χρησιμοποιεί διχρωμικό κάλιο ως οξειδωτικό παράγοντα και στη μεταξοτυπία φωτογραφίας.
- Στη φωτογραφία, ένα διάλυμα διχρωμικού καλίου μαζί με αραιό H2 SO4 χρησιμοποιείται στη δημιουργία αρνητικών.
- Η βιομηχανία μεταξοτυπίας τη χρησιμοποιεί επίσης λόγω της ιδιότητάς της να μαυρίζει το δέρμα και το δέρμα κατά την έκθεση στο φως.
- Οι μη υγροσκοπικές του ιδιότητες το καθιστούν εξαιρετικό χημικό αντιδραστήριο και χρησιμοποιούνται κυρίως για τον προσδιορισμό της συγκέντρωσης αιθανόλης.
- Ένα διάλυμα νιτρικού οξέος 35% και διχρωμικού καλίου ονομάζεται διάλυμα Schwerter. Χρησιμοποιείται για την ανάλυση μετάλλων όπως ο άργυρος και η καθαρότητά τους. Η δοκιμή δίνει διαφορετικές αποχρώσεις για διάφορες ποιότητες καθαρότητας αργύρου.
- Το χαρτί διχρωμικού καλίου γίνεται από πορτοκαλί σε πράσινο για να δώσει την αναλυτική δοκιμή του διοξειδίου του θείου.
- Χρησιμοποιείται στη στίλβωση και στο μαύρισμα ξύλου για να προσδώσει γυαλιστερό φινίρισμα στην επιφάνεια.
Κίνδυνοι από διχρωμικό κάλιο
Η ένωση είναι πολύ χρήσιμη αλλά απαιτεί αυστηρές προφυλάξεις. Ορισμένοι κίνδυνοι από το διχρωμικό κάλιο είναι οι εξής:
- Είναι πολύ καρκινογόνο.
- Η παρατεταμένη έκθεση μπορεί να οδηγήσει σε βλάβη των αναπνευστικών οργάνων, ακόμη και σε θάνατο.
- Η από του στόματος κατανάλωση έως και 40 γραμμαρίων ή περισσότερο οδηγεί σε άμεσο θάνατο ή σοβαρές παρενέργειες στον ανθρώπινο οργανισμό.
- Είναι πολύ διαβρωτικό και τείνει να καίει την εσωτερική επένδυση των εντέρων και του στομάχου όταν καταναλώνεται.
- Ακόμη και η έκθεση στο φως μπορεί να προκαλέσει συμπτώματα όπως υπερβολική ούρηση, έμετο και χαλαρή κίνηση.
- Το κάλιο στο διχρωμικό κάλιο μπορεί να οδηγήσει σε καρδιακές παθήσεις που έχουν ως αποτέλεσμα χαμηλή αρτηριακή πίεση, καρδιακή προσβολή, δυσλειτουργία του καρδιακού παλμού, πνιγμό των φλεβών του αίματος και άλλες επιπλοκές.
- Τα δερματικά εγκαύματα είναι ένα κοινό πρόβλημα στα εργαστήρια που χρησιμοποιούν διχρωμικό κάλιο.
- Μπορεί επίσης να προκαλέσει σοβαρή βλάβη στα μάτια ή τύφλωση.
- Η παρατεταμένη έκθεση μπορεί να οδηγήσει ακόμη και σε αναπαραγωγικές ασθένειες, βλάβη στο έμβρυο, απώλεια γονιμότητας στους άνδρες και άλλες γενετικές διαταραχές.
Συμπέρασμα
Το διχρωμικό κάλιο είναι μια άοσμη, κόκκινο-πορτοκαλί χρώματος ένωση που χρησιμοποιείται ευρέως στα εργαστήρια ως οξειδωτικός παράγοντας. Αποτελεί μέρος της περίφημης δοκιμής χρωμυλοχλωριδίου που χρησιμοποιείται για την ανάλυση ιόντων χλωρίου. Ωστόσο, λόγω της διαβρωτικής φύσης του, πρέπει να είστε προσεκτικοί κατά τη χρήση του αντιδραστηρίου, επειδή ακόμη και ήπιες εκθέσεις μπορεί να προκαλέσουν σοβαρούς κινδύνους.
Συχνές ερωτήσεις
1. Τι θα συμβεί αν αγγίξετε διχρωμικό κάλιο;
Α. Η επαφή με το διχρωμικό κάλιο μπορεί να προκαλέσει δερματικά εγκαύματα, ερυθρότητα και πόνο. Εάν έρθει σε επαφή με τα μάτια, μπορεί να οδηγήσει σε σοβαρά προβλήματα όπως τραυματισμό του κερατοειδούς ή τύφλωση.
2. Πώς θα εξουδετερώνατε το διχρωμικό κάλιο;
Α. Σε περίπτωση διαρροής διχρωμικού καλίου, μπορεί να εξουδετερωθεί χρησιμοποιώντας μεταδιθειώδες νάτριο ή όξινο θειώδες νάτριο.
3. Τι κάνει το διχρωμικό κάλιο καλό οξειδωτικό παράγοντα;
Α. Το διχρωμικό κάλιο είναι καλός οξειδωτικός παράγοντας επειδή τα στοιχεία που έρχονται σε επαφή γίνονται πιο ηλεκτραρνητικά και η κατάσταση οξείδωσης του ατόμου τους αυξάνεται. Η οξειδωτική του φύση ενισχύεται σε ένα όξινο μέσο.




