Οξαλικό [C2O4-2] – Δομή, Μοριακή Μάζα, Ιδιότητες &Χρήσεις
Όταν ήσασταν παιδιά, οι μεγαλύτεροι σας πρέπει να σας πίεζαν να τρώτε πράσινα φυλλώδη λαχανικά. Ρωτώντας τον λόγο, σας είπαν ότι αυτά είναι καλά για την ανάπτυξη και την υγεία σας. Πρέπει να σας πουν πολλά άλλα οφέλη από την κατανάλωση πράσινων λαχανικών.
Αλλά ξέρετε ότι αυτά τα πλούσια πράσινα λαχανικά είναι μια καλή πηγή οξαλικού οξέος εκτός από το ότι είναι πλούσια σε φυτικές ίνες; Καταναλώνετε πολλά άλλα τρόφιμα που περιέχουν οξαλικό οξύ και πολλές άλλες μορφές οξαλικών. Αλλά το ερώτημα είναι τι είναι τα οξαλικά; Και τι είναι το οξαλικό οξύ;
Ας βουτήξουμε σε αυτό το άρθρο για να μάθουμε περισσότερα για τα οξαλικά και το οξαλικό οξύ.
Τι είναι το Oxalate;
Το οξαλικό είναι ένα άχρωμο διαιόν. Το όνομά του κατά IUPAC είναι αιθανοδιοϊκό. Σε ορισμένα τρόφιμα, εμφανίζονται φυσικά. Είναι η συζευγμένη βάση του οξαλικού οξέος, γνωστό και ως διαιόν οξαλικού οξέος. Το οξαλικό χρησιμοποιείται συχνά για παράγωγα όπως άλατα οξαλικού οξέος. Για παράδειγμα, οξαλικό διμεθυλεστέρα ή οξαλικό νάτριο. Μπορεί κανείς να το αποκτήσει με αποπρωτονίωση των καρβοξυλομάδων του C2H2O4, δηλαδή των οξαλικών οξέων.
Υπό κανονικές συνθήκες, τα ιόντα οξαλικού είναι μη τοξικά. Ωστόσο, μπορεί να είναι τοξικό σε δυσμενές περιβάλλον.
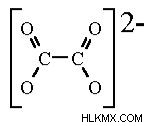
Οξαλική δομή
Ο μοριακός τύπος του οξαλικού ιόντος είναι C2O4-2. Υπάρχει σε επίπεδη διαμόρφωση. Υπάρχουν δύο μέρη σε αυτό που κάνει το οξαλικό ιόν επίπεδο. Η δομή του οξαλικού είναι -O2C-CO2- ή δύο καρβοξυλικά είναι συνδεδεμένα.
Ένα καρβοξυλικό, από μόνο του, είναι επίπεδο επειδή ο άνθρακας καρβονυλίου είναι υβριδισμένος sp2. Υπάρχει διπλός δεσμός (=) μεταξύ ενός από τα οξυγόνα και του άνθρακα.
Στην οξαλική δομή, υπάρχουν δύο καρβοξυλικά, το καθένα είναι επίπεδο, αλλά η διεδρική γωνία μεταξύ τους δεν χρειάζεται να είναι 0° ή 180° εάν ολόκληρο το μόριο είναι επίπεδο. Αυτό που προκαλεί τη γωνία να είναι περίπου 0° ή 180° (δηλαδή επίπεδη) είναι ότι μεγιστοποιεί την τροχιακή αλληλεπίδραση μεταξύ των δεσμών C=O σε κάθε άκρο.
Η δομή του οξαλικού ιόντος είναι η εξής:
Χρήσεις οξαλικού ιόντος
Τα φυσικά οξαλικά οξέα είναι επιζήμια για τον ανθρώπινο οργανισμό. Όμως, ορισμένα τεχνητά οξαλικά οξέα είναι χρήσιμα για την ανθρωπότητα με πολλούς τρόπους. Μερικές από αυτές τις χρήσεις είναι
- Οξαλικά άλατα βαρίου και στροντίου δρουν ως αναγωγικοί παράγοντες στα εργαστήρια χημείας και πυροτεχνίας.
- Η οξαλική εσιταλοπράμη είναι χρήσιμη στη θεραπεία του άγχους και της κατάθλιψης.
- Το άλας οξαλικού οξέος του ασβεστίου χρησιμοποιείται για την παραγωγή κεραμικών υλικών.
- Ο οξαλικός σίδηρος χρησιμοποιείται στην εκτύπωση πλατίνας και σε πολλούς άλλους σκοπούς.
- Οξαλικά ιόντα δρουν ως εξαιρετικός συνδέτης για μεταλλικά ιόντα.
- Το όξινο οξαλικό κάλιο, δηλ. το άλας της οξαλίδας, χρησιμοποιείται ως χημικό αντιδραστήριο λόγω της εμφάνισής του στο φυτό οξαλικής ξιφίας. Χρησιμοποιείται επίσης για την αφαίρεση λεκέδων μελανιού και στη φωτογραφία.
- Οξαλικά χρησιμοποιούνται ως πηγές των μετάλλων που περιέχουν.
- Το οξαλικό κοβάλτιο χρησιμοποιείται στην κατασκευή καταλυτών κοβαλτίου.
Οξαλικό οξύ και ο μοριακός τύπος του
Το οξαλικό οξύ είναι ένα οργανικό οξύ. Υπάρχει στο σπανάκι, τις ντομάτες και άλλα λαχανικά. Στο σώμα, συντίθεται από το οξαλοξικό, το οποίο διασπάται από την «οξαλοακετάση», ένα ένζυμο στο σώμα. Το οξαλικό οξύ αναστέλλει το ένζυμο γαλακτικής αφυδρογονάσης, το οποίο εμποδίζει την ανάπτυξη του όγκου. Χρησιμοποιείται ως χλωρίνη.
Το οξαλικό οξύ είναι μια οργανική ένωση που έχει τον μοριακό τύπο C2H2O4. Είναι ένα άχρωμο κρυσταλλικό στερεό που σχηματίζει ένα άχρωμο διάλυμα στο νερό. Το όνομα IUPAC του οξαλικού οξέος είναι Αιθανοδιοϊκό Οξύ.
Δομή οξαλικού οξέος
Η δομή του οξαλικού οξέος δίνεται παρακάτω:
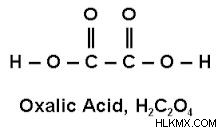
Σύμφωνα με το σθένος ενός ατόμου άνθρακα, σχηματίζει δεσμούς 3❜ και δεσμούς 1❜ με άτομα άνθρακα και οξυγόνου. Σχηματίζονται δύο δεσμοί 𝜎 μεταξύ δεσμών C-C και δεσμών -C-O-H και ένας διπλός δεσμός μεταξύ ατόμων C=O.
Η δομή του οξαλικού οξέος υπάρχει σε δύο μορφές, δηλαδή, άνυδρο και διένυδρο. Σε άνυδρη μορφή, υπάρχει σε δομή που μοιάζει με αλυσίδα και, ως αποτέλεσμα, σχηματίζει ένα μοτίβο σαν φύλλο. Ενώ είναι σε διένυδρη μορφή, σχηματίζει μια κρυσταλλική δομή.
Παρασκευή οξαλικού οξέος
Υπάρχουν διάφοροι τρόποι παρασκευής οξαλικού οξέος. Αυτά δίνονται παρακάτω:
1. Με νιτρικό οξύ (HNO3):
Το οξαλικό οξύ παρασκευάζεται με οξείδωση ορισμένων υδατανθράκων, για παράδειγμα, σακχαρόζης από έναν ισχυρό οξειδωτικό παράγοντα, το νιτρικό οξύ παρουσία ενός καταλύτη όπως το πεντοξείδιο του βαναδίου (V2O5).
C12H22O11 + 18[O] → (COOH)2 + H2O
2. Με ηλεκτροκατάλυση:
Σε αυτή τη μέθοδο, το οξαλικό οξύ υφίσταται ηλεκτροκατάλυση. Με τη βοήθεια ενός συμπλόκου χαλκού, το διοξείδιο του άνθρακα (CO2) ανάγεται σε οξαλικό οξύ. Σε αυτή τη διαδικασία, χρησιμοποιούνται μεγάλες ποσότητες διοξειδίου του άνθρακα.
3. Με τη βοήθεια αιθυλενογλυκόλης:
Κατά την οξείδωση, η αιθυλενογλυκόλη με οξινισμένο διχρωμικό κάλιο και θειικό οξύ δίνει οξαλικό οξύ. Η χημική αντίδραση είναι η εξής:
(CH2OH)2 + 4[O] → (COOH)2 + 2H2O
4. Από κυανογόνο:
Κατά την υδρόλυση του κυανογόνου με πυκνό υδροχλωρικό οξύ, λαμβάνεται οξαλικό οξύ. Η χημική αντίδραση είναι η εξής:
(CN)2 + 4H2O + 2HCl → (COOH)2 + 2NH4Cl
5. Με καρβονυλίωση αλκοόλης:
Σε αυτή τη διαδικασία, ο διεστέρας οξαλικού οξέος λαμβάνεται με καρβονυλίωση αλκοόλης.
6. Από μυρμηκικό νάτριο:
Σε αυτή τη διαδικασία, το οξαλικό οξύ παρασκευάζεται από μυρμηκικό νάτριο (OHCO-Na+) παρουσία ενός αλκαλικού καταλύτη. Αυτή η μέθοδος οδηγεί περαιτέρω στον σχηματισμό οξαλικού νατρίου (C2O4Na2), το οποίο αργότερα μετατρέπεται σε οξαλικό οξύ. Οι χημικές αντιδράσεις που λαμβάνουν χώρα είναι οι εξής:
OHCO-Na+ + 400°C θερμότητα → C2O4Na2 + H2
C2O4Na2 + υδατ. Ca(OH)2 → [C2O4]-2Ca+2 + NaOH
[C2O4]-2Ca⁺² + H2SO4 → (COOH)2 + CaSO4↓
Ιδιότητες του οξαλικού οξέος
Οι φυσικές και χημικές ιδιότητες του οξαλικού οξέος δίνονται παρακάτω:
1. Φυσικές ιδιότητες:
Μερικές φυσικές ιδιότητες του οξαλικού οξέος δίνονται παρακάτω:
- Είναι το μικρότερο διπλό καρβοξυλικό οξύ.
- Ο χημικός τύπος του οξαλικού οξέος είναι C2H2O4 ή (COOH)2.
- Είναι ένα άοσμο και λευκό κρυσταλλικό στερεό.
- Υπάρχει σε δύο μορφές:άνυδρο και διένυδρο.
- Η μοριακή μάζα του άνυδρου οξαλικού οξέος είναι 90,034 g/mol και η διένυδρη μορφή είναι 126,065 g/mol.
- Η πυκνότητα του άνυδρου οξαλικού οξέος είναι 1,90 g/cm³ και η διένυδρη μορφή είναι 1,653 g/cm³.
- Το σημείο τήξης του οξαλικού οξέος είναι 189-191°C.
- Η διαλυτότητα του οξαλικού οξέος στο νερό είναι 118 g/L σε θερμοκρασία δωματίου.
- Βρίσκεται συνήθως σε ένυδρη μορφή (COOH)₂⋅2H2O.
- Είναι ένα υδατοδιαλυτό καρβοξυλικό οξύ και καθώς απελευθερώνει ιόντα Η+ στο νερό, σχηματίζει ένα όξινο διάλυμα.
2. Χημικές ιδιότητες:
Μερικές χημικές ιδιότητες του οξαλικού οξέος δίνονται παρακάτω:
- Είναι το απλούστερο και ισχυρότερο δικαρβοξυλικό οξύ. Αντιδρά όπως το καρβοξυλικό οξύ και σχηματίζει εστερικά παράγωγα και χλωριούχο οξύ.
- Μπορεί να αντιδράσει με πενταχλωριούχο φώσφορο (PCl5) για να δημιουργήσει οξυχλωριούχο φώσφορο.
- Το άνυδρο οξαλικό οξύ είναι υδρόφιλο και προσελκύει νερό.
- Έχει ισχυρή όξινη ισχύ και μπορεί να δώσει εύκολα δύο πρωτόνια.
- Κατά τη θέρμανση, το οξαλικό οξύ υφίσταται αφαίρεση διοξειδίου του άνθρακα για την παραγωγή μυρμηκικού οξέος.
(COOH)2 + Θερμότητα → HCOOH + CO2
- Αν θερμανθεί παρουσία H2SO4, το οξαλικό οξύ δίνει μονοξείδιο του άνθρακα, διοξείδιο του άνθρακα και νερό.
(COOH)2 + Θερμότητα (παρουσία H2SO4) → CO + CO2 + H2O
- Χρησιμοποιείται για την ποσοτική ανάλυση του υπερμαγγανικού καλίου.
- Η οξείδωση του οξαλικού οξέος με KMnO4 ή K2Cr2O7 έχει ως αποτέλεσμα το σχηματισμό διοξειδίου του άνθρακα και νερού.
(COOH)2 + [O] → 2CO2 + H2O
- Λειτουργεί ως εξαιρετικός χηλικός συνδέτης για πολλά μεταλλικά κατιόντα.
Χρήση οξαλικού οξέος
Διάφορες χρήσεις του οξαλικού οξέος δίνονται παρακάτω:
- Περίπου το 25% της χρήσης οξαλικού οξέος γίνεται στη βιομηχανία βαφής και εκτύπωσης.
- Χρησιμοποιείται στη λεύκανση του ξυλοπολτού.
- Δρα ως αναγωγικός παράγοντας.
- Η βασική χρήση του καθαρισμού ή λεύκανσης με οξαλικό οξύ, ειδικά για την αφαίρεση σκουριάς που βρίσκεται σε σωλήνες υδραυλικών εγκαταστάσεων κ.λπ.
- Στη χημεία των λανθανιδών, είναι ένα από τα σημαντικά αντιδραστήρια.
- Μερικοί μελισσοκόμοι χρησιμοποιούν οξαλικό οξύ.
- Χρησιμοποιείται ως εργαστηριακό, αναλυτικό, ενδιάμεσο βαφής και χρωματογραφικό αντιδραστήριο ανάλυσης.
- Το οξαλικό οξύ είναι ένας λευκαντικός παράγοντας για το ξύλο. Αφαιρεί τα μαύρα στίγματα που δημιουργούνται από διαλυτωμένο σίδηρο που δένει με το ξύλο όταν το νερό το διαπερνά.
- Μερικές φορές χρησιμοποιείται στη διαδικασία ανοδίωσης αλουμινίου.
- Χρησιμοποιείται επίσης στον εξευγενισμό σπάνιων μετάλλων.
- Χρησιμοποιείται στην παρασκευή φαρμάκων όπως τα αντιβιοτικά.
Συμπέρασμα
Η ατελής οξείδωση των υδατανθράκων στα φυτά οδηγεί στη σύνθεση οξαλικών ενώσεων. Ενώ αντιδρούν με τα οξαλικά, πολλά μεταλλικά ιόντα σχηματίζουν μη διαλυτά ιζήματα. Μπορούν επίσης να σχηματίσουν ενώσεις συντονισμού. Το οξαλικό ασβέστιο είναι ένα κοινό άλας αυτού του είδους και το οξαλικό οξύ είναι το πιο γενικό οξύ που σχηματίζεται από την πρωτονίωση των οξαλικών ιόντων. Το κύριο συστατικό του πιο συνηθισμένου οξαλικού μπορεί να βρίσκεται στο ανθρώπινο σώμα με τη μορφή λίθων στα νεφρά.
Συχνές ερωτήσεις
1) Υπάρχουν κίνδυνοι για την υγεία που προκαλούνται από οξαλικά ιόντα;
Α) Τα οξαλικά μπορεί να ποικίλλουν με τη μορφή λίθων στα νεφρά που φράζουν τα νεφρικά σωληνάρια. Περίπου το 80% των λίθων στα νεφρά οφείλονται μόνο στο άλας οξαλικού ασβεστίου.
Τα οξαλικά ιόντα στο σώμα σας συνδυάζονται με διατομικά μεταλλικά κατιόντα όπως ο σίδηρος και το ασβέστιο και παράγουν κρυστάλλους των αντίστοιχων οξαλικών ενώσεων. Αυτοί οι κρύσταλλοι απεκκρίνονται από τα ούρα.
2) Ποιες είναι οι φυσικές πηγές οξαλικού;
Α) Το οξαλικό βρίσκεται φυσικά σε πολλά τρόφιμα, συμπεριλαμβανομένων των λαχανικών και των φρούτων, των ξηρών καρπών, των σπόρους, των όσπριων, των δημητριακών, της σοκολάτας και του τσαγιού. Ορισμένα τρόφιμα με περισσότερα επίπεδα οξαλικού είναι τα παντζάρια, το σπανάκι, το ραβέντι, τα φιστίκια, οι γλυκοπατάτες και η σοκολάτα.
3) Τι προκαλούν τα οξαλικά άλατα στο σώμα;
Α) Το οξαλικό είναι μια ιοντική μορφή οξαλικού οξέος, ενός τοξικού οξέος που σχηματίζεται στον οργανισμό από διάφορες πηγές τροφίμων. Η απορρόφηση αυτών των τροφών γίνεται στον πεπτικό σωλήνα. Αυτοί οι κρύσταλλοι οξαλικού άλατος σφηνώνουν την απορρόφηση και τη χρήση του ασβεστίου στο σώμα σας. Ως αποτέλεσμα, προκαλούν ασθένειες όπως οστεομαλακία και ραχίτιδα. Αυτές οι ασθένειες σχετίζονται με την αποδυνάμωση των οστών.