Ο νόμος του Avogadro έγινε εύκολος
Βασικές έννοιες του νόμου του Avogadro
Σε αυτό το άρθρο, θα μάθετε πώς η ποσότητα των σπίλων σχετίζεται με τον όγκο και πώς να χρησιμοποιήσετε τον νόμο του Avogadro για να προσδιορίσετε τη σχέση όγκου.
Θέματα που καλύπτονται σε άλλα άρθρα
- Τι είναι η πίεση
- Νόμος μερικής πίεσης του Ντάλτον
- Νόμος του Καρόλου
- Νόμος του Μπόιλ
- Ο νόμος του ιδανικού αερίου
- Η εξίσωση κατάστασης του Van der Waal
- Κινητική Μοριακή Θεωρία
- Συνδυασμένος νόμος για τα αέρια
Σημαντικά πράγματα που πρέπει να λάβετε υπόψη
Ο νόμος για τα αέρια που περιγράφεται σε αυτό το άρθρο ισχύει μόνο για τα ιδανικά αέρια, για τα οποία μπορείτε να διαβάσετε στο άρθρο μας, Ο νόμος του ιδανικού αερίου .
Πίεση και κρεατοελιές
Θεωρήστε ένα έμβολο γεμάτο με 1 mole οξυγόνου. Το έμβολο έχει πίεση 1 atm. Όπως γνωρίζουμε από το άρθρο μας Τι είναι η πίεση , η πίεση του αερίου εξαρτάται από το άθροισμα των συγκρούσεων των σωματιδίων του αερίου με τα τοιχώματα.
Τώρα, σκεφτείτε τι θα συνέβαινε αν προσθέταμε άλλο ένα mole οξυγόνου στη δεξαμενή. Τώρα, η ποσότητα των σωματιδίων διπλασιάζεται και έτσι το άθροισμα των συγκρούσεων διπλασιάζεται επίσης.
Από αυτό το διπλάσιο σε ποσότητα συγκρούσεων, η δύναμη που ασκείται διπλασιάζεται και επομένως η πίεση διπλασιάζεται επίσης. Δεδομένου ότι το έμβολο μπορεί να αλλάξει σε όγκο για να εξισορροπήσει την πίεση, το έμβολο διαστέλλεται, σύμφωνα με το νόμο του Boyle, και ο όγκος αυξάνεται.
Από αυτό, μπορούμε να αρχίσουμε να βλέπουμε τη σχέση μεταξύ κρεατοελιών και όγκου.
Η σχέση του νόμου του Avogadro
Ο νόμος του Avogadro περιγράφει αυτή τη σχέση, ο οποίος δηλώνει ότι η ποσότητα των κρεατοελιών και ο όγκος είναι ανάλογα. Αυτό μπορεί να περιγραφεί από την εξίσωση: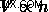 .
.
Από το Νόμο του Μπόιλ, το γνωρίζουμε αυτό 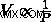 . Από αυτή τη σχέση, μπορούμε να ξαναγράψουμε τον νόμο του Avogadro ως
. Από αυτή τη σχέση, μπορούμε να ξαναγράψουμε τον νόμο του Avogadro ως 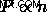 .
.
Σχέση σταθερής θερμοκρασίας
Επειδή η ποσότητα των γραμμομορίων είναι ανάλογη με τον όγκο και η ποσότητα των γραμμομορίων ενός αερίου σε ένα δοχείο δεν εξαρτάται από την ταυτότητα του αερίου, ο όγκος μιας ορισμένης ποσότητας mol είναι πάντα ο ίδιος για μια δεδομένη θερμοκρασία και πίεση.
Σε τυπικές συνθήκες, για ένα ιδανικό αέριο, αυτός ο όγκος είναι 22,4 L. Αυτό σημαίνει ότι κάθε 1 mol αερίου σε 1 atm και 273 Κελσίου θα καταλαμβάνει 22,4 L.
Πρόβλημα παραδείγματος νόμου του Avogadro
Ακολουθεί ένα παράδειγμα για το πώς μπορείτε να χρησιμοποιήσετε τον νόμο του Avogadro για να λύσετε προβλήματα.
Ένα μετεωρολογικό μπαλόνι έχει γεμίσει με 25 moles αερίου ηλίου και καταλαμβάνει όγκο 600 L. Το μπαλόνι είναι υπερβολικά φουσκωμένο και ως εκ τούτου οι μετεωρολόγοι που το σχεδίασαν αποφάσισαν να βγάλουν λίγο αέριο ήλιο. Το τυπικό μέγεθος ενός μετεωρολογικού μπαλονιού είναι 521 L. Πόσα mole ηλίου πρέπει να αφαιρεθούν για να μειωθεί ο όγκος του μπαλονιού σε ένα ασφαλές μέγεθος;
Λύση:
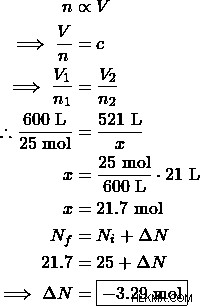
Επομένως, οι μηχανικοί πρέπει να βγάλουν 3,29 mol αερίου ηλίου.




