Ο Νόμος του Ιδανικού Αερίου
Βασικές έννοιες του νόμου του ιδανικού αερίου
Σε αυτό το σεμινάριο, θα μάθετε πώς προέκυψε η εξίσωση του νόμου του ιδανικού αερίου και πώς να τη χρησιμοποιήσετε. Θα μάθετε επίσης τι ορίζει ένα ιδανικό αέριο, ποια είναι η σταθερά του ιδανικού αερίου, μονάδες νόμου του ιδανικού αερίου και ποιες υποθέσεις κάνουμε για να ονομάσουμε ένα ιδανικό αέριο – τις ιδιότητες του ιδανικού αερίου.
Θέματα που καλύπτονται σε άλλα άρθρα
- Τι είναι η πίεση
- Νόμος μερικής πίεσης του Ντάλτον
- Νόμος του Καρόλου
- Νόμος του Avogadro
- Νόμος του Μπόιλ
- Η εξίσωση του Van der Waal
- Κινητική Θεωρία Αερίων
- Νόμος του Gay Lussac
- Συνδυασμένος νόμος για τα αέρια
- Νόμος του Χένρι
Εισαγωγή
Ο νόμος του ιδανικού αερίου είναι μια εξίσωση κατάστασης που περιγράφει τα ιδανικά αέρια. Αυτή η εξίσωση κατάστασης συσχετίζει την πίεση, τον όγκο, τη θερμοκρασία και τη μάζα ενός αερίου και είναι πολύ χρήσιμη για να περιγράψει πώς θα συμπεριφέρονται τα αέρια σε ιδανικές συνθήκες. Αυτή είναι η πιο κοινή εξίσωση κατάστασης για τα αέρια.
Μερικά αξιοσημείωτα άλλα είναι η εξίσωση κατάστασης του Van der Waal και η Virial, που και οι δύο περιγράφουν την κατάσταση των αερίων σε μη ιδανική πολιτείες. Δείτε το άρθρο μας για την Εξίσωση του Van der Waal για να μάθετε περισσότερα σχετικά με αυτό.
Η εξίσωση του ιδανικού αερίου αναφέρθηκε για πρώτη φορά από τον Benoît Paul Émile Clapeyron το 1834 ως συνδυασμός του νόμου του Boyle, του νόμου του Charles, του νόμου του Avogadro και του νόμου του Gay-Lussac. Ο Clapeyton ήταν Γάλλος μηχανικός και ένας από τους ιδρυτές της θερμοδυναμικής.
Ποιες είναι οι ιδιότητες του Ideal Gas;
Τα αέρια αποτελούνται από μεγάλο αριθμό σωματιδίων που συγκρούονται συνεχώς μεταξύ τους τυχαία. Προκειμένου να μοντελοποιηθεί και να προβλεφθεί η συμπεριφορά των αερίων, δημιουργήθηκε η έννοια του ιδανικού αερίου. Για να είναι το αέριο ιδανικό, πρέπει να γίνουν μερικές υποθέσεις. Αυτές μπορούν επίσης να θεωρηθούν ως οι ιδανικές ιδιότητες αερίου .
- Για ένα, υποθέτουμε ότι ο όγκος των σωματιδίων αερίου είναι αμελητέος. Αυτό σημαίνει ότι ο όγκος του δοχείου είναι πολύ μεγαλύτερος από τον όγκο των σωματιδίων αερίου.
- Η δεύτερη υπόθεση που κάνουμε είναι ότι τα σωματίδια αερίου έχουν το ίδιο μέγεθος και δεν έχουν διαμοριακές δυνάμεις με άλλα σωματίδια αερίου.
- Τρίτον, υποθέτουμε ότι τα σωματίδια του αερίου κινούνται τυχαία σύμφωνα με τους Νόμους της Κίνησης του Νεύτωνα.
- Τέλος, υποθέτουμε ότι όλες οι συγκρούσεις είναι απόλυτα ελαστικές και δεν έχουν καμία απώλεια ενέργειας. Αυτό σημαίνει ότι οι συγκρούσεις μεταξύ των σωματιδίων αερίου και των τοίχων δεν χάνουν ενέργεια και ασκούν σταθερή πίεση.
Αν και κανένα αέριο δεν είναι απόλυτα ιδανικό, τα περισσότερα αέρια βρίσκονται αρκετά κοντά σε θερμοκρασία δωματίου και είναι σχεδόν ιδανικά.
Συνδυασμός των νόμων των αερίων στην εξίσωση του νόμου του ιδανικού αερίου
Αν λάβουμε υπόψη τους τρεις βασικούς νόμους των αερίων, τον νόμο του Charles, τον νόμο του Avogadro και τον νόμο του Boyle, μπορούμε να δημιουργήσουμε σχέσεις μεταξύ της πίεσης, του όγκου, της θερμοκρασίας και της ποσότητας γραμμομορίων ενός αερίου. Λαμβάνοντας κάθε εξίσωση και συνδυάζοντάς τες, μπορούμε να εξαγάγουμε την εξίσωση του νόμου του ιδανικού αερίου.
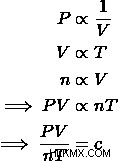
Επειδή αυτή η αναλογικότητα λαμβάνει υπόψη όλες τις αλλαγές της κατάστασης των αερίων, θα είναι σταθερή για ένα ιδανικό αέριο. Αυτή η σταθερά είναι γνωστή ως Ιδανική σταθερά αερίου , ή Universal Gas Constant, και έχει τιμή 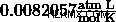 . Μπορούμε να συνδέσουμε αυτήν τη σταθερά, με ετικέτα
. Μπορούμε να συνδέσουμε αυτήν τη σταθερά, με ετικέτα 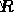 , στην εξίσωση για την εξαγωγή του νόμου του ιδανικού αερίου,
, στην εξίσωση για την εξαγωγή του νόμου του ιδανικού αερίου,  .
.
Μονάδες νόμου για το ιδανικό αέριο
Οι ακόλουθες μονάδες χρησιμοποιούνται στην εξίσωση του νόμου του ιδανικού αερίου, όταν χρησιμοποιούνται μονάδες SI (διεθνές σύστημα μονάδων).
- Το P είναι η πίεση που μετράται σε Pascals, Pa.
- V είναι ο όγκος που μετράται σε κυβικά μέτρα, m
- n είναι ο αριθμός των σπίλων.
- R =8,3145 είναι η καθολική σταθερά αερίου που μετράται σε J/(K · mol) , ή εναλλακτικά m·Pa / (K · mol)
- T είναι η θερμοκρασία που μετρήθηκε σε Kelvin.
Εάν χρησιμοποιείτε λίτρα και ατμόσφαιρες πίεσης, αντί για Pascal και κυβικά μέτρα, τότε έχετε τα εξής:
- Το P είναι η πίεση που μετράται σε ατμόσφαιρες
- V είναι ο όγκος που μετράται σε λίτρα
- n είναι ο αριθμός των σπίλων.
- R =0,08206 είναι η καθολική σταθερά αερίου που μετράται σε L·atm /(K · mol)
- T είναι η θερμοκρασία που μετρήθηκε σε Kelvin.
Πρόβλημα παραδείγματος νόμου του ιδανικού αερίου
- Ένα μείγμα αιθανόλης και μεθανόλης καίγεται σε οξυγόνο για να παραχθούν 35 cm CO2 και 55 cm H2 O. Συμβαίνει πλήρης καύση και οι όγκοι και των δύο προϊόντων μετρώνται στα 101 kPa και στους 120 βαθμούς Κελσίου. Ποια είναι η μοριακή αναλογία, αιθανόλη προς μεθανόλη, στο μείγμα;

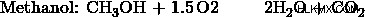
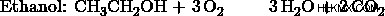
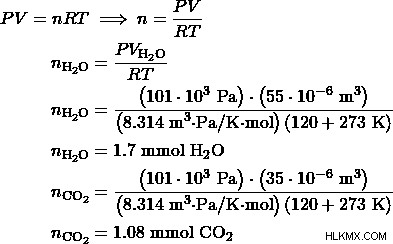
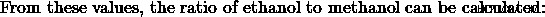
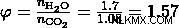
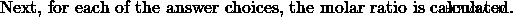
α) Έστω η αναλογία αιθανόλης:μεθανόλης 1:3. Τότε, η αντίδραση μεθανόλης θα συμβεί 3 φορές περισσότερο από την αντίδραση αιθανόλης. Έτσι, τα προϊόντα μεθανόλης θα είναι 3 φορές περισσότερα από τα προϊόντα αιθανόλης.
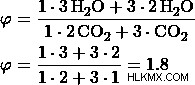
β) Έστω η αναλογία 2:3.
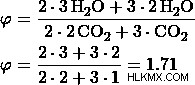
γ) Έστω η αναλογία 3:2.
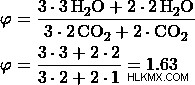
δ) Έστω η αναλογία 3:1
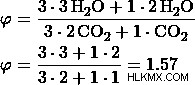
Από αυτές τις τιμές, μπορούμε να δούμε ότι η επιλογή (d) έχει την ίδια μοριακή αναλογία όπως υπολογίσαμε προηγουμένως, και επομένως η επιλογή (δ) είναι η σωστή απάντηση.




