Πώς να διαβάσετε τον Περιοδικό Πίνακα
Βασικές έννοιες:
Σε αυτό το σεμινάριο, θα μάθετε πώς να διαβάζετε τον περιοδικό πίνακα. Θα ρίξουμε μια προσεκτική ματιά στις ομάδες του περιοδικού πίνακα. Επιπλέον, θα μάθετε για τις διαφορετικές ιδιότητες των ομάδων, περιόδων και οικογενειών του περιοδικού πίνακα. Εάν σας αρέσει αυτό το άρθρο, φροντίστε να δείτε και τα άλλα μας!
Σχετικά άρθρα:
- Εύκολες περιοδικές τάσεις
- Στοιχεία
- Πώς να γράψετε διαμορφώσεις κελύφους ηλεκτρονίων
- Τάση ατομικής ακτίνας
- Τάση ενέργειας ιονισμού
- Περιοδικός πίνακας με ονόματα στοιχείων
Λεξιλόγιο
- Στοιχεία:Μια καθαρή ουσία που αποτελείται από ένα μόνο άτομο με μοναδικό ατομικό αριθμό.
- Ομάδες:Η κατακόρυφη στήλη του περιοδικού πίνακα που υποδηλώνει τον αριθμό των ηλεκτρονίων σθένους σε ένα στοιχείο.
- Περίοδοι:Οι οριζόντιες σειρές στον περιοδικό πίνακα που δηλώνουν τον αριθμό των φλοιών ηλεκτρονίων σε ένα στοιχείο.
- Οικογένειες:Στοιχεία που έχουν τον ίδιο αριθμό ηλεκτρονίων σθένους και επομένως παρόμοιες ιδιότητες.
Δείτε τις τάσεις, τις οικογένειες και τις ομάδες διαδραστικά!
Πιστεύουμε ότι ο περιοδικός μας πίνακας είναι ένας από τους καλύτερους στον κόσμο! Επισκεφθείτε τον νέο μας διαδραστικό περιοδικό πίνακα. Μπορείτε να δείτε κάθε είδους τάσεις, ιδιότητες, μαγνητισμό, ηλεκτρόνια, ακόμη και άρθρα για όλα τα στοιχεία!
Ο Περιοδικός Πίνακας και οι Περιοδικές Τάσεις
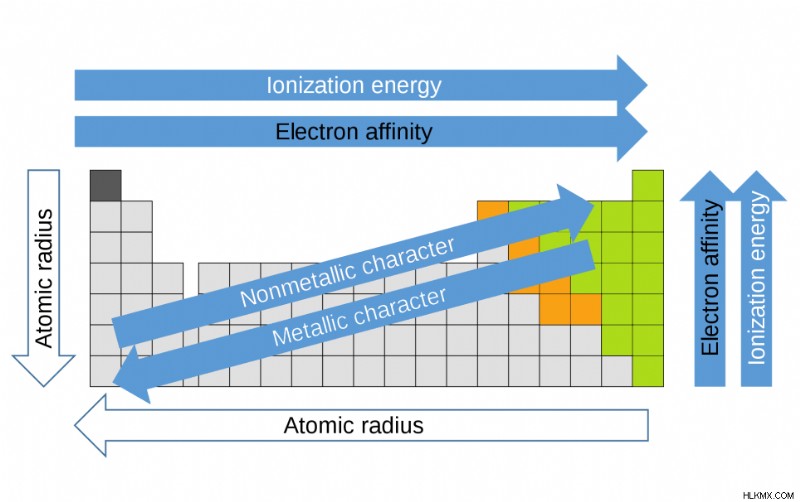
Ο περιοδικός πίνακας οργανώνεται σε ομάδες (κάθετες στήλες), περιόδους (οριζόντιες σειρές) και οικογένειες (ομάδες στοιχείων που είναι παρόμοια). Στοιχεία στην ίδια ομάδα έχουν τον ίδιο αριθμό ηλεκτρονίων σθένους. Εν τω μεταξύ, στοιχεία στην ίδια περίοδο έχουν τον ίδιο αριθμό κατειλημμένων φλοιών ηλεκτρονίων. Το 1869 ο Ρώσος χημικός Dmitri Mendeleev παρατήρησε ότι υπήρχε ένα έμφυτο πρότυπο οργάνωσης για τα χημικά στοιχεία. Από αυτή την αφαίρεση, σχημάτισε τον περιοδικό πίνακα. Είναι σημαντικό να σημειώσουμε πώς η θέση των στοιχείων σε αυτόν τον πίνακα μας λέει για τις ιδιότητές τους. Ένας γρήγορος τρόπος για να κατανοήσετε τις χημικές και φυσικές ιδιότητες ενός στοιχείου είναι να γνωρίζετε τις περιοδικές τάσεις. Αυτές οι τάσεις σας λένε πού συγκεντρώνονται οι υψηλότεροι και οι χαμηλότεροι τύποι ιδιοτήτων στον περιοδικό πίνακα. Για μια πιο εμπεριστατωμένη εξήγηση των περιοδικών τάσεων, κάντε κλικ εδώ.
Ομάδα εναντίον περιόδου
Οι ομάδες είναι οι στήλες του περιοδικού πίνακα και οι περίοδοι οι σειρές. Υπάρχουν 18 ομάδες και υπάρχουν 7 περίοδοι συν τις λανθανίδες και τις ακτινίδες.
Περίοδοι στον Περιοδικό Πίνακα
Τι είναι λοιπόν μια περίοδος στον περιοδικό πίνακα; Περίοδοι είναι οι οριζόντιες σειρές του περιοδικού πίνακα. Υπάρχουν συνολικά επτά περίοδοι και κάθε στοιχείο σε μια περίοδο έχει τον ίδιο αριθμό ατομικών τροχιακών. Η κορυφαία περίοδος, που περιέχει υδρογόνο και ήλιο, έχει μόνο δύο τροχιακά. Καθώς κατεβαίνετε τις σειρές, ο αριθμός των τροχιακών αυξάνεται. Παρακάτω είναι ένας πίνακας που βοηθά στην απεικόνιση του περιοδικού αριθμού και των αντίστοιχων τροχιακών.
| Αριθμός περιόδου | Αριθμός τροχιακών | Αριθμός στοιχείων |
| 1 | 1 | 2 |
| 2 | 2 | 8 |
| 3 | 3 | 8 |
| 4 | 4 | 18 |
| 5 | 5 | 18 |
| 6 | 6 | 32 |
| 7 | 7 | 32 |
Ομάδες του περιοδικού πίνακα
Όπως αναφέρθηκε προηγουμένως, οι κάθετες στήλες στον περιοδικό πίνακα ονομάζονται «ομάδες». Υπάρχουν δεκαοκτώ ομάδες στον περιοδικό πίνακα συνολικά και κάθε ομάδα περιοδικού πίνακα περιέχει στοιχεία με τον ίδιο αριθμό ηλεκτρονίων σθένους.
Ο αριθμός των ηλεκτρονίων σθένους που υπάρχουν υπαγορεύει τις ιδιότητες ενός στοιχείου. Ο λόγος για αυτό είναι ότι τα ηλεκτρόνια σθένους, τα οποία είναι τα ηλεκτρόνια στο εξωτερικό περίβλημα, είναι αυτά που συμμετέχουν στις χημικές αντιδράσεις. Αυτά τα ηλεκτρόνια είτε δωρίζουν είτε δέχονται είτε μοιράζονται. Επιπλέον, όσο πιο γεμάτο είναι το κέλυφος σθένους, τόσο πιο σταθερό είναι το στοιχείο.
Πόσες ομάδες υπάρχουν στον περιοδικό πίνακα;
Υπάρχουν 18 ομάδες στον περιοδικό πίνακα, μία για κάθε στήλη του περιοδικού πίνακα. Η πρώτη στήλη στα αριστερά είναι η ομάδα 1 και η τελευταία στήλη στα δεξιά είναι η ομάδα 18.
Ομάδες και ηλεκτρόνια σθένους
Η πρώτη ομάδα είναι η λιγότερο σταθερή καθώς έχει μόνο ένα ηλεκτρόνιο σθένους. Εν τω μεταξύ, η ομάδα δεκαοκτώ είναι η πιο σταθερή καθώς αυτά τα στοιχεία έχουν ένα πλήρες κέλυφος σθένους (οκτώ ηλεκτρόνια σθένους). Ακολουθεί ένας πίνακας που συσχετίζει τους αριθμούς των ομάδων με τον αριθμό των ηλεκτρονίων σθένους.
| Αριθμός ομάδας | Αριθμός ηλεκτρονίων σθένους |
| 1 | 1 |
| 2 | 2 |
| 3-12 | 2 |
| 13 | 3 |
| 14 | 4 |
| 15 | 5 |
| 16 | 6 |
| 17 | 7 |
| 18 | 8 |
Οικογένειες του περιοδικού πίνακα
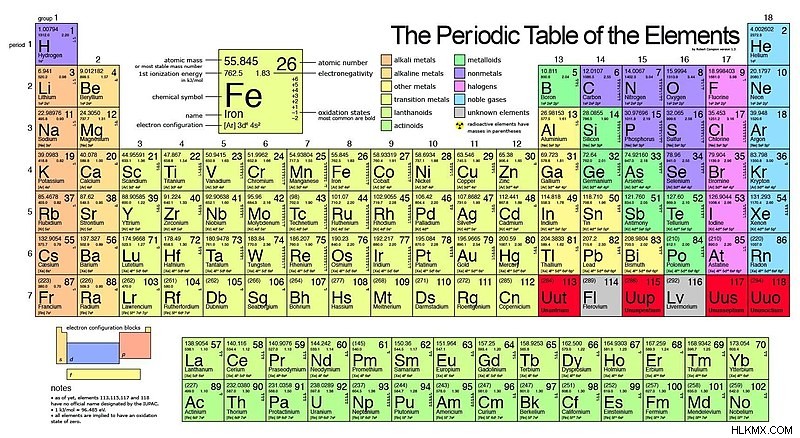
Στον περιοδικό πίνακα υπάρχουν οικογένειες που είναι ομάδες στοιχείων με παρόμοιες ιδιότητες. Αυτές οι οικογένειες είναι αλκαλικά μέταλλα, μέταλλα αλκαλικών γαιών, μέταλλα μετάπτωσης, μέταλλα μετά τη μετάβαση, μεταλλοειδή, αλογόνα, ευγενή μέταλλα και ευγενή αέρια. Πολλές από αυτές τις οικογένειες ανήκουν σε μια ενιαία ομάδα στον περιοδικό πίνακα. Ωστόσο, δεν επικαλύπτονται όλες οι οικογένειες με ομάδες περιοδικού πίνακα. Για παράδειγμα, τα μέταλλα μετάπτωσης περιέχουν όλα τα στοιχεία από την ομάδα τρία έως την ομάδα δώδεκα. Παρακάτω είναι ένας περιοδικός πίνακας όπου εμφανίζεται η τοποθεσία κάθε οικογένειας.
The Alkali Metals (Ομάδα 1)
Τα αλκαλιμέταλλα αποτελούνται από όλα τα στοιχεία της πρώτης ομάδας με εξαίρεση το υδρογόνο. Αυτά τα στοιχεία είναι εξαιρετικά αντιδραστικά και για το λόγο αυτό, βρίσκονται συνήθως σε ενώσεις. Επιπλέον, είναι ευαίσθητα στο νερό (αντιδρούν βίαια με το νερό), επομένως πρέπει να φυλάσσονται σε λάδι. Το πιο δραστικό αλκαλιμέταλλο είναι το φράγκιο και μειώνεται όσο ανεβαίνετε στην ομάδα. Αυτό σημαίνει ότι το λίθιο είναι το λιγότερο αντιδραστικό. Φυσικά, η οικογένεια των αλκαλιμετάλλων είναι ασημί, λευκή και ελαφριά. Έχουν επίσης χαμηλά σημεία τήξης και χαμηλά σημεία βρασμού.
The Alkaline Earth Metals (Ομάδα 2)
Τα μέταλλα των αλκαλικών γαιών είναι η δεύτερη πιο δραστική οικογένεια στον περιοδικό πίνακα (μετά από τα αλκαλικά μέταλλα). Επιπλέον, είναι ισχυροί αναγωγικοί παράγοντες που σημαίνει ότι δίνουν ηλεκτρόνια σε χημικές αντιδράσεις. Είναι επίσης καλοί θερμικοί και ηλεκτρικοί αγωγοί. Φυσικά, έχουν χαμηλή πυκνότητα, χαμηλό σημείο τήξης και χαμηλό σημείο βρασμού.
Μέταλλα σπάνιων γαιών:Λανθανίδες
Οι λανθανίδες είναι μια οικογένεια μετάλλων σπάνιων γαιών που περιέχουν ένα ηλεκτρόνιο σθένους στο 5d κέλυφος. Είναι εξαιρετικά δραστικά και ισχυρός αναγωγικός παράγοντας στις αντιδράσεις. Επιπλέον, είναι ένα ασημί-φωτεινό μέταλλο και είναι σχετικά μαλακό. Έχουν επίσης υψηλά σημεία τήξης και υψηλά σημεία βρασμού. Οι σπάνιες γαίες περιλαμβάνουν στοιχεία όπως το νεοδύμιο και το έρβιο.
Μέταλλα σπανίων γαιών:ακτινίδες
Οι ακτινίδες είναι μια άλλη οικογένεια μετάλλων σπάνιων γαιών. Όπως και οι λανθανίδες, αυτά τα στοιχεία είναι εξαιρετικά αντιδραστικά. Έχουν επίσης υψηλή ηλεκτροθετικότητα και είναι ραδιενεργά. Επιπλέον, αυτά τα στοιχεία περιέχουν παραμαγνητικές, πυρόμορφες και αλλοτροπικές ιδιότητες. Φυσικά, μοιάζουν πολύ με τις λανθανίδες. Είναι ασημένια μέταλλα που είναι μαλακά, ελατά και όλκιμα.
The Transition Metals (Ομάδες 3-11)
Τα μέταλλα μετάπτωσης τυπικά σχηματίζουν δύο ή περισσότερες καταστάσεις οξείδωσης. Έχουν χαμηλές ενέργειες ιονισμού και υψηλή αγωγιμότητα. Επιπλέον, έχουν υψηλά σημεία τήξης, υψηλά σημεία βρασμού και υψηλή αγωγιμότητα. Φυσικά είναι και μεταλλικά και ελατά.
Post Transition Metal
Τα μεταβατικά μέταλλα βρίσκονται μεταξύ των μετάλλων μετάπτωσης και των μεταλλοειδών. Σε τυπική θερμοκρασία, βρίσκονται σε στερεή κατάσταση ύλης. Τείνουν να έχουν υψηλή πυκνότητα καθώς και υψηλή αγωγιμότητα. Φυσικά είναι εύπλαστα και όλκιμα.
Τα Μεταλλοειδή
Τα μεταλλοειδή εμφανίζουν ιδιότητες τόσο των μετάλλων όσο και των μη μετάλλων. Για παράδειγμα, τα μέταλλα είναι καλοί αγωγοί και τα αμέταλλα είναι κακοί αγωγοί. Αυτό σημαίνει ότι τα μεταλλοειδή είναι ημιαγωγοί (αγώγουν ηλεκτρισμό μόνο σε υψηλές θερμοκρασίες.). Επίσης, είναι πιο εύθραυστα από τα μέταλλα αλλά λιγότερο εύθραυστα από τα μη μέταλλα. Φυσικά μπορεί να είναι είτε γυαλιστερά είτε θαμπά και είναι συνήθως όλκιμα και εύπλαστα.
The Halogens (Ομάδα 17)
Το όνομα αλογόνο σημαίνει στα ελληνικά «αλατοποιητές». Αυτό είναι εμφανές στη φύση καθώς τα αλογόνα αλληλεπιδρούν με μέταλλα για να σχηματίσουν διάφορα άλατα. Σε μια άλλη σημείωση, τα αλογόνα είναι μια μοναδική ομάδα στοιχείων. Είναι η μόνη περιοδική οικογένεια που περιέχει στοιχεία στις τρεις καταστάσεις της ύλης σε τυπική θερμοκρασία. Υπάρχουν 6 αλογόνα και βρίσκονται στην ομάδα 17. Αυτά τα στοιχεία περιλαμβάνουν το φθόριο (F), το χλώριο (Cl), το βρώμιο (Br), το ιώδιο (I) και την αστατίνη (At). Είναι εξαιρετικά αντιδραστικά, εξαιρετικά ηλεκτραρνητικά και εξαιρετικά τοξικά μη μέταλλα.
Ευγενή μέταλλα
Τα ευγενή μέταλλα αποτελούνται από ρουθήνιο (Ru), όσμιο (Os), ρόδιο (Rh), ιρίδιο (Ir), Pd, πλατίνα (Pt), χρυσό (Au), ασήμι (Ag). Όπως τα ευγενή αέρια, είναι αδρανή λόγω του ότι έχουν πλήρες κέλυφος σθένους. Επιπλέον, τα ευγενή μέταλλα έχουν καταλυτικές τάσεις. Επίσης, είναι πολύ ανθεκτικά στη διάβρωση, την αμαύρωση και την οξείδωση. Τέλος, όπως πολλά άλλα μέταλλα, είναι μαλακά και όλκιμα.
Noble Gases (Ομάδα 18)
Τα ευγενή αέρια, που ονομάζονται και αερογόνα, είναι αδρανή αέρια. Μερικά παραδείγματα περιλαμβάνουν αργό, κρυπτό και νέον. Μπορούν να βρεθούν στην ομάδα δεκαοκτώ στον περιοδικό πίνακα. Ομοίως, αυτό σημαίνει ότι έχουν ένα πλήρες κέλυφος σθένους. Για το λόγο αυτό, είναι σταθερά και σχετικά μη αντιδραστικά. Επιπλέον, τα ευγενή αέρια έχουν χαμηλά σημεία βρασμού και χαμηλά σημεία τήξης. Φυσικά είναι άχρωμα και δεν έχουν μυρωδιά.
Δείτε μερικά ενδιαφέροντα στοιχεία
Συνοπτικός πίνακας για οικογενειακές ιδιότητες
| Τύπος οικογένειας | Ιδιότητες |
| Μέταλλα Αλκαλίων | – εξαιρετικά αντιδραστικό – ευαίσθητο στο νερό – Μαλακό - χαμηλή πυκνότητα - χαμηλό σημείο τήξης – χαμηλό σημείο βρασμού |
| Μέταλλα Αλκαλικής Γης | – Ισχυροί αναγωγικοί παράγοντες – Ασημί, γυαλιστερό μέταλλο – Καλοί μαέστροι - Χαμηλή πυκνότητα – Χαμηλό σημείο τήξης – Χαμηλό σημείο βρασμού |
| Μέταλλα μετάβασης | – 2 ή περισσότερες καταστάσεις οξείδωσης – Συνήθως σχηματίζει παραμαγνητικές ενώσεις – Χαμηλές ενέργειες ιονισμού – Υψηλό σημείο τήξης – Υψηλό σημείο βρασμού – Υψηλή αγωγιμότητα – Μεταλλικό – Ελατό |
| Μετάλλου μετάβασης | – Στερεό σε τυπική θερμοκρασία - Ελατός – όλκιμο – Υψηλή αγωγιμότητα – Υψηλή πυκνότητα |
| Μεταλλοειδή | – Ημιαγωγοί (αγώγονται μόνο σε υψηλές θερμοκρασίες) – Πιο εύθραυστο από τα μέταλλα αλλά λιγότερο εύθραυστο από τα μη μέταλλα – Οι ιδιότητες είναι ένα μείγμα μετάλλων και μη μετάλλων – Γυαλιστερό ή θαμπό – Εύκαμπτο και ελατό |
| Λανθανίδες | – 1 ηλεκτρόνιο σθένους σε 5d κέλυφος – Εξαιρετικά αντιδραστικό – Ισχυρός αναγωγικός παράγοντας – Ασημί φωτεινό μέταλλο – Σχετικά μαλακό – Υψηλά σημεία τήξης – Υψηλά σημεία βρασμού |
| Ακτινίδες | – Εξαιρετικά αντιδραστικό – Υψηλή ηλεκτροθετικότητα – Παραμαγνητικό – Πυρομορφικό – Αλλοτροπικό – Ραδιενεργό – Ασημένια μέταλλα – Ελκή - Ελατός – Μαλακό |
| Αλογόνα | – Εξαιρετικά αντιδραστικό – Υψηλή ηλεκτραρνητικότητα – Μη μεταλλικά – Τοξικό |
| Ευγενή μέταλλα | – Σχετικά μη αντιδραστικό – Πλήρες κέλυφος σθένους (8 ηλεκτρόνια σθένους) – Αδρανή – Καταλυτικό – Ανθεκτικό στη διάβρωση, την αμαύρωση και την οξείδωση – Μαλακό και όλκιμο |
| Ευγενή αέρια | – Σχετικά μη αντιδραστικό – Πλήρες κέλυφος σθένους (8 ηλεκτρόνια σθένους) – Χαμηλή ηλεκτραρνητικότητα – Άχρωμο και άοσμο – αέρια υπό τυπικές συνθήκες – Μη μεταλλικά – Χαμηλό σημείο βρασμού – Χαμηλό σημείο τήξης – Η πυκνότητα αυξάνεται καθώς κατεβαίνετε |
Δείτε ένα δροσερό πείραμα χημείας
Περαιτέρω ανάγνωση
Η δομή ενός ατόμου
Οι περιοδικές τάσεις γίνονται εύκολα!




