Μοριακή Γεωμετρία και Γωνίες Δεσμών
Βασικές έννοιες
Σε αυτό το σεμινάριο, θα μάθετε πώς να αναγνωρίζετε τη μοριακή γεωμετρία και τις γωνίες σύνδεσης ενός μορίου. Θα μάθετε για τις πιο κοινές μοριακές γεωμετρίες:τετραεδρική, γραμμική, λυγισμένη, τριγωνική πυραμιδική και τριγωνική επίπεδη – μαζί με τις γωνίες δεσμών τους.
Εάν σας αρέσει αυτό το σεμινάριο, μη διστάσετε να δείτε τους άλλους οδηγούς μας για τη συγκόλληση που αναφέρονται παρακάτω.
Καλύπτεται σε άλλα άρθρα
- Μοριακοί δεσμοί
- Δομές Lewis
Λεξιλόγιο
- Γεωμετρία ηλεκτρονίων:Περιγράφει τη διάταξη των δεσμών και των μεμονωμένων ζευγών γύρω από ένα κεντρικό άτομο.
- Μοριακή Γεωμετρία:Περιγράφει τη διάταξη των ατόμων γύρω από το κεντρικό άτομο με αναγνώριση μόνο των δεσμών ηλεκτρονίων.
- Υβριδισμός:Τα τροχιακά συνδυάζονται για να διασπείρουν ηλεκτρόνια.
- Γωνίες δεσμού:Η γωνία μεταξύ γειτονικών δεσμών ενός ατόμου.
Τι είναι η μοριακή γεωμετρία;
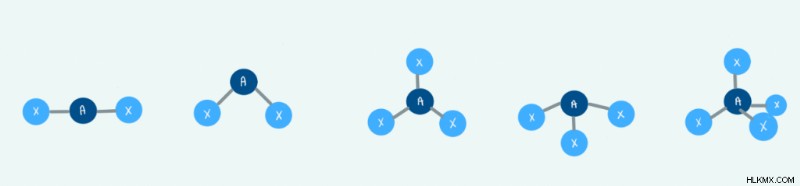
Η μοριακή γεωμετρία περιγράφει την τρισδιάστατη δομή ενός μορίου. Οι χημικοί είναι σε θέση να προβλέψουν τη διάταξη των ατόμων και των χημικών δεσμών χρησιμοποιώντας τη θεωρία απώθησης ζεύγους ηλεκτρονίων κελύφους σθένους ή VSEPR. Αυτή η θεωρία περιστρέφεται γύρω από την ιδέα ότι τα ηλεκτρόνια απωθούν το ένα το άλλο και επομένως θα συνδεθούν ανάλογα.
Τύποι διαμορφώσεων και γωνίες
Υπάρχουν τρεις κύριοι τύποι διαμορφώσεων:γραμμική, τριγωνική και τετραεδρική. Ακολουθεί ένας πίνακας που δείχνει τη σχέση μεταξύ του αριθμού των συνεργατών σύνδεσης και αυτών των διαμορφώσεων.
| Διαμόρφωση | Συγκόλληση προσαρτημάτων | Γωνία δεσμού |
| Γραμμικό | 2 | 180 |
| Τριγωνικό | 3 | 120 |
| Τετραεδρικό | 4 | 109,5 |
Προσδιορισμός μοριακής γεωμετρίας και γωνιών δεσμού
Για να προσδιορίσουμε τη μοριακή γεωμετρία μιας δομής πρέπει να γνωρίζουμε δύο πράγματα. Πρώτον, πρέπει να γνωρίζουμε πόσα συνολικά συνημμένα υπάρχουν. Επιπλέον, πρέπει να γνωρίζουμε πόσες από αυτές τις προσκολλήσεις είναι δεσμοί και μοναχικά ζεύγη. Παρατηρήστε στον παρακάτω πίνακα πώς εάν δεν υπάρχουν μεμονωμένα ζεύγη, η μοριακή γεωμετρία και η γεωμετρία των ηλεκτρονίων θα είναι ίδια.
Στον παρακάτω πίνακα, θα δείτε τον συντονισμό μεταξύ του αριθμού και του τύπου των προσαρτημάτων σε σχέση με τις γωνίες σύνδεσης. Ως επί το πλείστον, αυτές οι πληροφορίες θα πρέπει να απομνημονευθούν.
| Συνημμένα | Μοριακή Γεωμετρία | Γεωμετρία ηλεκτρονίων | Υβριδισμός | Γωνίες δεσμού |
| 2 | γραμμικό | γραμμικό | sp | 180 |
| 3 | τριγωνικό επίπεδο | τριγωνικό επίπεδο | sp | 120 |
| 3 (2 ομόλογα και 1 μοναχικό ζεύγος) | λυγισμένο | τριγωνικό επίπεδο | sp | περίπου 118 |
| 4 | τετραεδρικό | τετραεδρικό | sp | 109,5 |
| 4 (3 ομόλογα και 1 μοναχικό ζεύγος) | τριγωνική πυραμιδική | τετραεδρικό | sp | <109,5 |
| 4 (2 ομόλογα και 2 μοναχικά ζεύγη) | λυγισμένο | τετραεδρικό | sp | περίπου 105 |
Παράδειγμα εξάσκησης:
Ποια είναι η μοριακή γεωμετρία και η γωνία δεσμού του νερού (H2 O)?
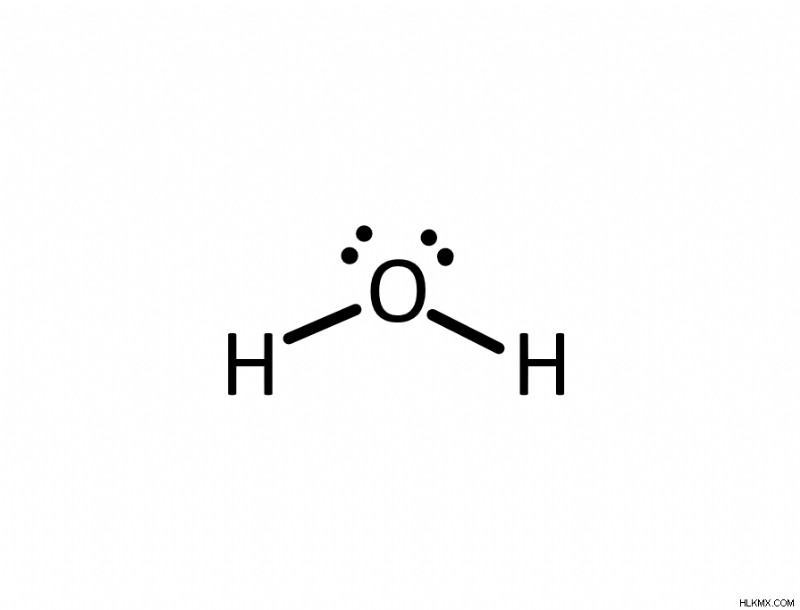
Η απάντηση είναι ότι η μοριακή γεωμετρία του νερού θα ήταν λυγισμένη. Παρατηρήστε ότι υπάρχουν 4 προσκολλήσεις ή ομάδες ηλεκτρονίων που περιβάλλουν το οξυγόνο. Αυτό θα έκανε τη γεωμετρία των ηλεκτρονίων τετραεδρική. Ωστόσο, αυτή δεν είναι η μοριακή γεωμετρία. Δύο από αυτές τις προσκολλήσεις είναι δεσμοί και οι άλλες δύο είναι μοναχικά ζεύγη. Επομένως, η μοριακή γεωμετρία που προκύπτει είναι μια λυγισμένη γεωμετρία. Τώρα που γνωρίζουμε τη μοριακή γεωμετρία, μπορούμε να προσδιορίσουμε ότι η γωνία δεσμού είναι περίπου 105 μοίρες από το διάγραμμά μας.
Ποια είναι η μοριακή γεωμετρία του BF3 , τριφθοριούχο βόριο;

Αν σχεδιάσουμε τη δομή των ηλεκτρονίων για το BF3 , τριφθοριούχο βόριο, θα παρατηρήσουμε ότι υπάρχουν τρία σημεία σύνδεσης και 3 δεσμοί, με το κεντρικό άτομο, το βόριο. Με βάση το διάγραμμα, η μοριακή γεωμετρία για το BF3 θα ήταν τριγωνικό επίπεδο, με γωνία 120 μοιρών μεταξύ των δεσμών.




