Πώς να γράψετε μια διαμόρφωση ηλεκτρονίων
Έννοιες
Σε αυτό το σεμινάριο, θα μάθετε πώς να βρίσκετε και να γράφετε τη διαμόρφωση ηλεκτρονίων και τροχιακό διάγραμμα για διάφορα στοιχεία χρησιμοποιώντας τον περιοδικό πίνακα. Θα μάθετε την αρχή του Aufbau, τον κανόνα του Hund και την αρχή του αποκλεισμού Pauli. Εάν σας αρέσει αυτό το σεμινάριο, φροντίστε να ελέγξετε τα άλλα μας που συνδέονται παρακάτω!
Σχετικά άρθρα
- Μοριακές Γεωμετρίες
- Δομή Lewis
- Τροχιακά ηλεκτρονίων και σχήματα τροχιών
Η διαμόρφωση ηλεκτρονίων
Η διαμόρφωση ηλεκτρονίων είναι μια περιγραφή του σημείου που βρίσκονται τα ηλεκτρόνια σε ένα μόριο ή άτομο. Τα ηλεκτρόνια καταλαμβάνουν τροχιακά που έχουν χαρακτηριστικά επίπεδα ενέργειας. Συστήματα με μεγαλύτερο αριθμό ηλεκτρονίων θα καταλαμβάνουν μεγαλύτερη ποσότητα ενεργειακών επιπέδων, που σημαίνει ότι θα χρησιμοποιούν επίσης υψηλότερα επίπεδα ενέργειας. Οι διαμορφώσεις ηλεκτρονίων αντιπροσωπεύονται με τυπική γραπτή σημείωση ή με χρήση τροχιακών διαγραμμάτων.
Εγγραφή διαμορφώσεων ηλεκτρονίων
Οι διαμορφώσεις ηλεκτρονίων έχουν μια τυπική σημείωση που σας λέει τα βασικά ενεργειακά επίπεδα και τα υποεπίπεδα που καταλαμβάνουν τα ηλεκτρόνια. Εδώ είναι η διαμόρφωση ηλεκτρονίων για το Ήλιο:
1s
Ο πρώτος ακέραιος, 1, μας δίνει το αρχικό επίπεδο ενέργειας , το γράμμα s αντιπροσωπεύει τον τύπο του τροχιακού (υποεπίπεδο) , και ο εκθέτης 2 μας δίνει την κατοχή ηλεκτρονίων . Σε αυτή την περίπτωση, υπάρχουν δύο ηλεκτρόνια σε ένα τροχιακό s με βασικό επίπεδο ενέργειας το ένα.
Συστήματα με μεγαλύτερο αριθμό ηλεκτρονίων θα καταλαμβάνουν μεγαλύτερη ποσότητα ενεργειακών επιπέδων. Η διαμόρφωση ηλεκτρονίων για το λίθιο είναι:
1s 2s
Το λίθιο, που περιέχει τρία ηλεκτρόνια, έχει δύο ηλεκτρόνια που καταλαμβάνουν ένα τροχιακό s στο πρώτο ενεργειακό επίπεδο και ένα ηλεκτρόνιο που καταλαμβάνει ένα τροχιακό s στο δεύτερο ενεργειακό επίπεδο.
Ο περιοδικός πίνακας είναι ένα χρήσιμο εργαλείο για τη σύνταξη αυτών των διαμορφώσεων. Το βασικό επίπεδο ενέργειας υποδεικνύεται από έναν ακέραιο (1, 2, 3, …7) που αντιστοιχεί στις περιόδους στον περιοδικό πίνακα. Κάθε διαδοχικός ακέραιος γενικά αντιπροσωπεύει ένα υψηλότερο επίπεδο ενέργειας από το τελευταίο. Τα υποεπίπεδα υποδεικνύονται με τα γράμματα s, p, d και f. Ομάδες ή μπλοκ του περιοδικού πίνακα μοιράζονται το ίδιο υποεπίπεδο και χωρίζονται όπως φαίνεται στο παρακάτω διάγραμμα.
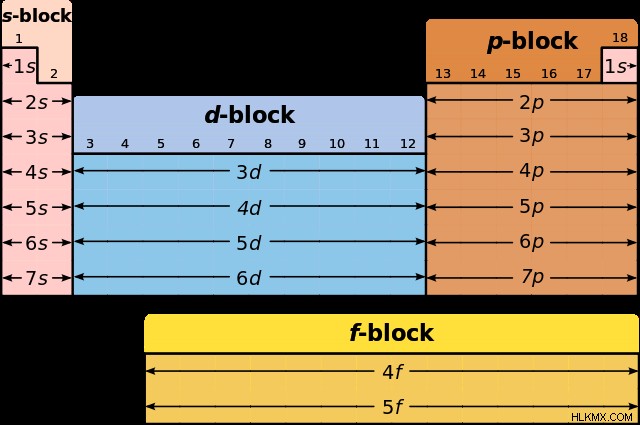
Εγγραφή διαμορφώσεων ηλεκτρονίων – Παραδείγματα
Για να βρείτε τη διαμόρφωση ηλεκτρονίων ενός στοιχείου, ξεκινήστε από το υδρογόνο και ιχνηλατήστε σε κάθε περίοδο έως ότου επιτευχθεί το στοιχείο-στόχος σας. Σε κάθε προηγούμενο στοιχείο, δώστε προσοχή στο επίπεδο ενέργειας και μπλοκ που αντιπροσωπεύει. Ας εξασκηθούμε σε αυτήν την ενότητα παρακάτω.
Λίθιο
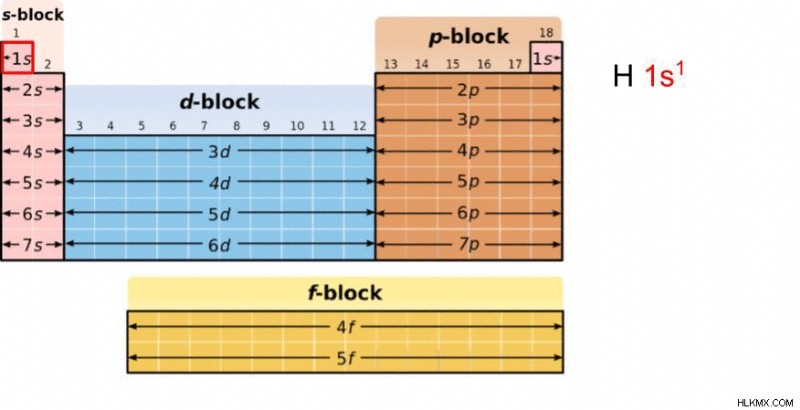
Για άλλη μια φορά θα χρησιμοποιήσουμε το παράδειγμα του λιθίου. Ξεκινάμε με την προσοχή μας στο υδρογόνο (1s), μεταβαίνουμε στο Ήλιο (1s) και μετά στο Λίθιο (2s). Επομένως, η διαμόρφωση ηλεκτρονίων για το λίθιο είναι 1s 2s .
Σημείωση:Το πρώτο μισό της διαμόρφωσης ηλεκτρονίων του λιθίου γράφεται χρησιμοποιώντας μόνο «1s» και όχι «1s1s», επειδή μεταξύ Υδρογόνου και Ήλιου, το επίπεδο ενέργειας και η τροχιακή δεν αλλάζουν. Αλλάζει μόνο η κατάληψη ηλεκτρονίων, την οποία συμβολίζουμε αλλάζοντας τον εκθέτη από 1 σε 2.
Άνθρακας

Ακολουθήστε τον περιοδικό πίνακα ξεκινώντας από το υδρογόνο ακριβώς όπως το παράδειγμα για το λίθιο. Ο άνθρακας βρίσκεται στη δεύτερη περίοδο και στο μπλοκ p, επομένως τα ηλεκτρόνια με την υψηλότερη ενέργεια θα καταλαμβάνουν το τροχιακό 2p. Η διαμόρφωση του κελύφους ηλεκτρονίων είναι 1s2s2p. Μπορούμε επίσης να επιβεβαιώσουμε αυτή την απάντηση παρατηρώντας ότι ο άνθρακας είναι ο αριθμός έξι στον περιοδικό πίνακα και επομένως έχει έξι ηλεκτρόνια. Αν μετρήσουμε τα ηλεκτρόνια σε κάθε τροχιακό για τη διαμόρφωση του άνθρακα, θα έχουμε 2+2+2=6!
Φώσφορος
Τώρα, ας βρούμε τον φώσφορο στον περιοδικό πίνακα. Βρίσκεται στην τρίτη περίοδο και εντός του p-block. Επιπλέον, έχει δεκαπέντε ηλεκτρόνια. Η διαμόρφωση του κελύφους ηλεκτρονίων για τον φώσφορο θα είναι 1s2s2p3s3p.
Διαμορφώσεις ηλεκτρονίων εγγραφής – Μέθοδος συντομογραφίας
Μπορείτε ακόμα να γράψετε κάθε μεμονωμένο υποκέλυφος αν θέλετε, αλλά για να εξοικονομήσετε χρόνο είναι καλό να γνωρίζετε τη συντομογραφική μέθοδο των διαμορφώσεων ηλεκτρονίων. Η μέθοδος συντομογραφίας χρησιμοποιεί τα στοιχεία της ομάδας 18, τα ευγενή αέρια, ως σελιδοδείκτη.
Βρώμιο
Το βρώμιο βρίσκεται στην τέταρτη περίοδο του μπλοκ p. Θυμηθείτε, για τις διαμορφώσεις ηλεκτρονίων, εργάζεστε από αριστερά προς τα δεξιά και προς τα κάτω κατά τις περιόδους μέχρι να φτάσετε στο στοιχείο στο οποίο εστιάζετε. Το τελευταίο ευγενές αέριο που διοχετεύθηκε για βρώμιο ήταν το αργό (Ar). Χρησιμοποιώντας τη μέθοδο του short-hand, θα τοποθετήσουμε αργό σε αγκύλες όπως αυτή [Ar] και στη συνέχεια θα συνεχίσουμε τη διαμόρφωση ηλεκτρονίων μετά το αργό. Θα μοιάζει με αυτό:[Ar] 4s3d4p.
Χλώριο
Το χλώριο βρίσκεται στην τρίτη περίοδο του μπλοκ p. Το τελευταίο ευγενές αέριο που πέρασε για χλώριο ήταν το νέο (Ne). Χρησιμοποιώντας τη μέθοδο σύντομου χεριού, θα τοποθετήσουμε νέον σε αγκύλες και στη συνέχεια θα συνεχίσουμε τη διαμόρφωση ηλεκτρονίων. Θα μοιάζει με αυτό:[Ne] 3s2 3p5.
Τι είναι ένα τροχιακό διάγραμμα;
Ένας άλλος τρόπος για να αναπαραστήσουμε μια διαμόρφωση ηλεκτρονίων είναι μέσω ενός τροχιακού διαγράμματος. Σε ένα τροχιακό διάγραμμα, τα τροχιακά αντιπροσωπεύονται ως κουτιά και τα ηλεκτρόνια αντιπροσωπεύονται με βέλη (↑ ή ↓), με δύο ηλεκτρόνια να καταλαμβάνουν κάθε τροχιακό/κουτί. Τα τροχιακά επισημαίνονται σύμφωνα με τα βασικά ενεργειακά τους επίπεδα και υποεπίπεδα (1s, 2p, κ.λπ.). Ήλιο, με δύο ηλεκτρόνια στο τροχιακό 1s έχει το ακόλουθο τροχιακό διάγραμμα.
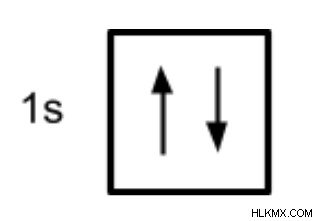
Για να σχεδιάσετε με επιτυχία ένα τροχιακό διάγραμμα, πρέπει να γνωρίζετε μερικές αρχές που υπαγορεύουν τον τρόπο πλήρωσης αυτών των τροχιακών.
Αρχή του Aufbau
Το Aufbau είναι γερμανικό για το «χτίσιμο», επομένως αυτός ο κανόνας υπαγορεύει πώς γεμίζονται τα τροχιακά με βάση τις ενεργειακές τους καταστάσεις. Η αρχή δηλώνει ότι τα τροχιακά ηλεκτρονίων χαμηλότερης ενέργειας θα γεμίσουν πριν από τα τροχιακά υψηλότερης ενέργειας. Έτσι, το τροχιακό 1s θα γεμίσει πριν από το τροχιακό 2s, και το τροχιακό 2s θα γεμίσει πριν από το τροχιακό 2p, και ούτω καθεξής. Ωστόσο, το κέλυφος 4s θα γεμίσει πριν από το κέλυφος 3d επειδή το κέλυφος 4s είναι χαμηλότερης ενέργειας από το κέλυφος 3d.
Στο παρακάτω παράδειγμα, η διαμόρφωση Α δείχνει ένα πλήρως κατειλημμένο τροχιακό 1s και ένα μισό κατειλημμένο τροχιακό 2s. Η διαμόρφωση Β δείχνει ένα μισοκατειλημμένο τροχιακό 1s και ένα πλήρως κατειλημμένο τροχιακό 2s. Με βάση την Αρχή του Aufbau, ποια πιστεύετε ότι είναι η διαμόρφωση ηλεκτρονίων του λιθίου;
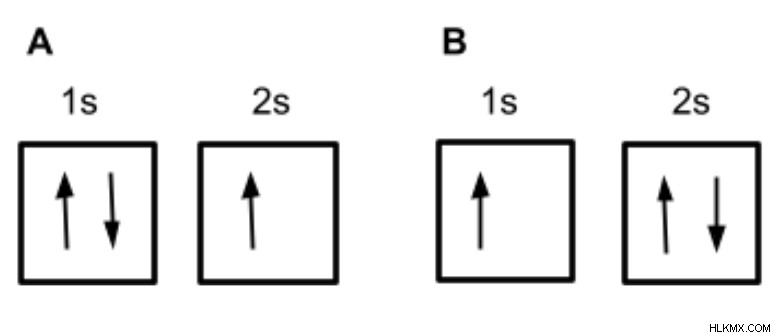
Δεδομένου ότι το τροχιακό 1s είναι μικρότερης ενέργειας από το τροχιακό 2s, το τροχιακό 1s θα πρέπει να γεμίσει πρώτα και κάθε ηλεκτρόνιο που απομένει θα πρέπει να χρησιμοποιηθεί για να γεμίσει το τροχιακό 2s, καθιστώντας τη διαμόρφωση Α το σωστό τροχιακό διάγραμμα για το λίθιο.
Στη συνέχεια, πώς γεμίζουμε τα τροχιακά αν είναι της ίδιας ενέργειας;
Κανόνας του Χουντ
Ο κανόνας του Hund υπαγορεύει πώς πρέπει να γεμίζονται τροχιακά της ίδιας ενέργειας. Ένα ηλεκτρόνιο δίνεται σε καθένα από αυτά τα τροχιακά πριν δύο ηλεκτρόνια καταλάβουν το ίδιο τροχιακό. Τα μεμονωμένα ηλεκτρόνια θα έχουν επίσης το ίδιο σπιν (που υποδεικνύεται από την κατεύθυνση των βελών στα τροχιακά διαγράμματα).
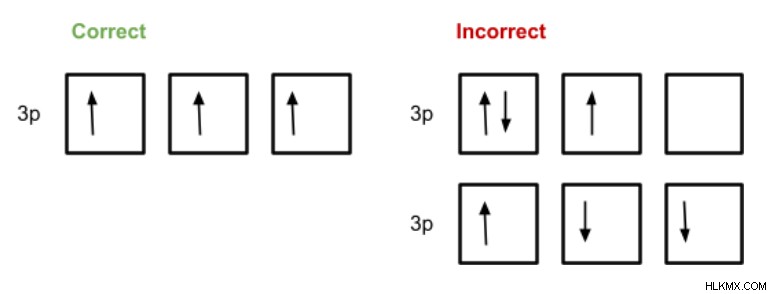
Στη σωστή διαμόρφωση, ένα ηλεκτρόνιο γεμίζει κάθε τροχιακό και κάθε ηλεκτρόνιο έχει το ίδιο σπιν. Η πρώτη εσφαλμένη διαμόρφωση δείχνει ότι δεν ήταν όλα τα τροχιακά μισογεμάτα πριν από την προσθήκη δύο ηλεκτρονίων σε ένα τροχιακό. Και στο δεύτερο σωστό παράδειγμα, δεν έχουν όλα τα μεμονωμένα ηλεκτρόνια το ίδιο σπιν.
Πώς πρέπει να καταλαμβάνονται τρία τροχιακά 2p για το Οξυγόνο;
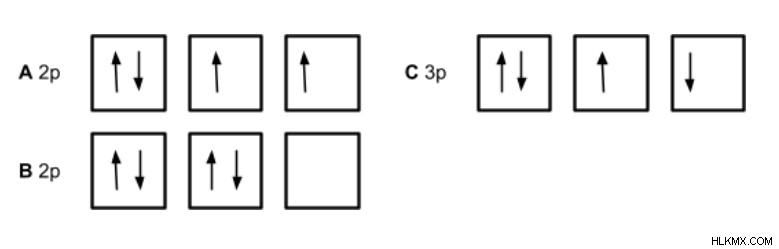
Η επιλογή Α είναι η σωστή διαμόρφωση, επειδή όλα τα τροχιακά καταλήφθηκαν μεμονωμένα πριν δύο ηλεκτρόνια καταλάβουν το τροχιακό, και όλα τα μεμονωμένα ηλεκτρόνια έχουν το ίδιο σπιν.
Αρχή αποκλεισμού Pauli
Η αρχή του αποκλεισμού Pauli δηλώνει ότι κανένα ηλεκτρόνιο σε ένα άτομο ή μόριο δεν μπορεί να έχει τους ίδιους τέσσερις κβαντικούς αριθμούς. Για τους σκοπούς μας, αυτό σημαίνει ότι δύο ηλεκτρόνια που καταλαμβάνουν τα ίδια τροχιακά δεν μπορούν να έχουν το ίδιο σπιν. Ένα πρέπει να είναι spin up (↑) και ένα πρέπει να spin down (↓).
Ποιο δείχνει το σωστό τροχιακό διάγραμμα για ένα τροχιακό 1s που περιέχει 2 ηλεκτρόνια;

Η διαμόρφωση Α είναι σωστή, επειδή τα ηλεκτρόνια έχουν αντίθετα σπιν, όπως υποδεικνύεται από την κατεύθυνση των βελών.
Σημείωση:Είναι επίσης συμβατικό να σχεδιάζετε το πρώτο βέλος που δείχνει προς τα πάνω.
Διαμόρφωση ηλεκτρονίου – Περαιτέρω ανάγνωση
- Τρόπος ανάγνωσης του περιοδικού πίνακα
- Δομή ενός ατόμου




