Διαφορά μεταξύ ενεργοποιημένου συμπλέγματος και κατάστασης μετάβασης
Κύρια διαφορά – Ενεργοποιημένο σύμπλεγμα έναντι κατάστασης μετάβασης
Η χημική αντίδραση είναι μια διαδικασία που περιλαμβάνει αναδιάταξη της μοριακής ή ιοντικής δομής μιας ουσίας, σε αντίθεση με μια αλλαγή στη φυσική μορφή ή μια πυρηνική αντίδραση. Μια χημική αντίδραση μπορεί να συμβεί απευθείας μέσω ενός μόνο σταδίου ή μπορεί να συμβεί μέσω πολλών σταδίων. Το ενεργοποιημένο σύμπλοκο και η μεταβατική κατάσταση είναι δύο όροι που εξηγούνται σχετικά με μια χημική αντίδραση με πολλαπλά στάδια ή στάδια. Το ενεργοποιημένο σύμπλοκο αναφέρεται σε μια συλλογή ενδιάμεσων μορίων που σχηματίζονται κατά την εξέλιξη μιας χημικής αντίδρασης. Εδώ, η εξέλιξη της χημικής αντίδρασης αναφέρεται στη μετατροπή των αντιδρώντων σε προϊόντα. Η μεταβατική κατάσταση μιας χημικής αντίδρασης είναι ενδιάμεση με την υψηλότερη δυναμική ενέργεια. Η κύρια διαφορά μεταξύ ενεργοποιημένου συμπλέγματος και μεταβατικής κατάστασης είναι ότι τοενεργοποιημένο σύμπλεγμα αναφέρεται σε όλα τα πιθανά ενδιάμεσα ενώ η κατάσταση μετάβασης αναφέρεται στο ενδιάμεσο με την υψηλότερη δυναμική ενέργεια.
Βασικές περιοχές που καλύπτονται
1. Τι είναι το Activated Complex
– Ορισμός, Εξήγηση
2. Τι είναι η κατάσταση μετάβασης
– Ορισμός, Εξήγηση
3. Ποια είναι η σχέση μεταξύ του ενεργοποιημένου συμπλέγματος και της κατάστασης μετάβασης
4. Ποια είναι η διαφορά μεταξύ ενεργοποιημένου συμπλέγματος και κατάστασης μετάβασης
– Σύγκριση βασικών διαφορών
Βασικοί όροι:Ενεργοποιημένο σύμπλοκο, Χημική αντίδραση, Ενδιάμεσο, Προϊόντα, Δυνητική Ενέργεια, Αντιδρώντα, Κατάσταση Μετάβασης

Τι είναι το Activated Complex
Το ενεργοποιημένο σύμπλεγμα αναφέρεται σε μια συλλογή ενδιάμεσων μορίων που σχηματίζονται κατά την εξέλιξη μιας χημικής αντίδρασης. Ένα ενεργοποιημένο σύμπλοκο είναι μια ασταθής διάταξη ατόμων των αντιδρώντων. Ως εκ τούτου, οι ενδιάμεσες διατάξεις ή τα ενεργοποιημένα σύμπλοκα έχουν υψηλότερη δυναμική ενέργεια από τα αντιδρώντα. Λόγω της αστάθειάς του, ένα ενεργοποιημένο σύμπλεγμα υπάρχει για πολύ σύντομο χρονικό διάστημα.
Το ενεργοποιημένο σύμπλεγμα μπορεί να αποτελεί ή να μην αποτελεί τα τελικά προϊόντα. Αυτό σημαίνει ότι τα ενεργοποιημένα σύμπλοκα μερικές φορές πηγαίνουν προς τα πίσω, δίνοντας τα αντιδρώντα πίσω παρά πηγαίνουν προς τα εμπρός για να σχηματίσουν προϊόντα. Μια χημική αντίδραση περιλαμβάνει το σπάσιμο και το σχηματισμό χημικών δεσμών. Το ενεργοποιημένο σύμπλοκο σχηματίζεται όταν σπάνε δεσμοί και σχηματίζονται μεταξύ διαφορετικών ατόμων.
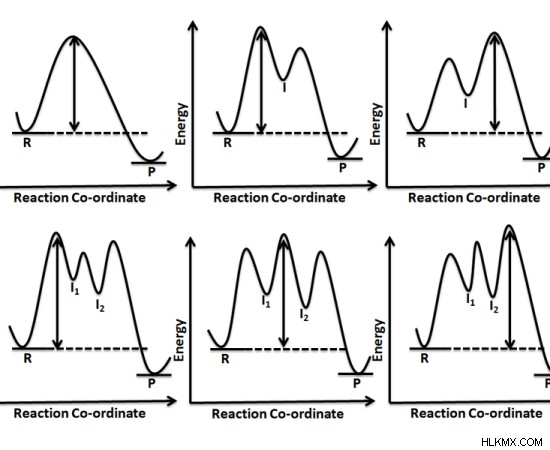
Εικόνα 1:Διαφορετικές χημικές αντιδράσεις με διαφορετικά ενδιάμεσα
Αλλά για να σπάσουν και να σχηματιστούν χημικοί δεσμοί, θα πρέπει να παρέχεται ενέργεια στα αντιδρώντα. Επομένως, τα αντιδρώντα κολλοειδή μεταξύ τους σε κατάλληλο προσανατολισμό για να συμβεί η αντίδραση. Αυτές οι συγκρούσεις σχηματίζουν ενεργοποιημένα συμπλέγματα.
Τι είναι η κατάσταση μετάβασης
Η μεταβατική κατάσταση είναι το ενδιάμεσο μιας χημικής αντίδρασης που περιλαμβάνει την υψηλότερη δυναμική ενέργεια. Για χημικές αντιδράσεις που έχουν μόνο ένα ενδιάμεσο, αυτό το ενδιάμεσο θεωρείται ως η μεταβατική κατάσταση. Μια χημική αντίδραση με δύο ή περισσότερα στάδια έχει τρία στάδια:αρχικό στάδιο μόνο με αντιδραστήρια, μεταβατική κατάσταση με ενδιάμεσα και τελικό στάδιο με προϊόντα. Επομένως, η μεταβατική κατάσταση αναφέρεται στο στάδιο όπου τα αντιδρώντα μετατρέπονται σε προϊόντα.
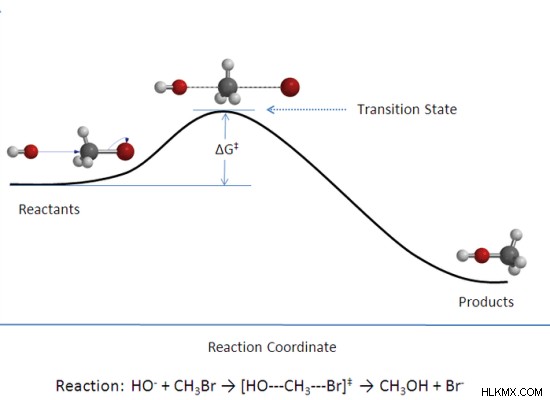
Εικόνα 2:Κατάσταση μετάβασης
Υπάρχει μεγάλη πιθανότητα η μεταβατική κατάσταση να προχωρήσει προς τα εμπρός για να σχηματίσει προϊόντα αντί να επιστρέψει για να σχηματίσει ξανά αντιδρώντα. Προκειμένου να καταστεί επιτυχής μια χημική αντίδραση, το μόριο του αντιδρώντος πρέπει να κολλοειδές μεταξύ τους με σωστό προσανατολισμό. Η μεταβατική κατάσταση ή το ενδιάμεσο με την υψηλότερη δυναμική ενέργεια είναι εξαιρετικά ασταθές. Επομένως, δεν υπάρχει για μεγάλο χρονικό διάστημα. Αυτό καθιστά δύσκολη την αποτύπωση της μεταβατικής κατάστασης μιας χημικής αντίδρασης.
Ενέργεια ενεργοποίησης
Η ενέργεια ενεργοποίησης μιας χημικής αντίδρασης είναι το ενεργειακό εμπόδιο που πρέπει να ξεπεραστεί για να ληφθούν προϊόντα από την αντίδραση. Είναι η ελάχιστη ενέργεια που απαιτείται για να μετατραπεί ένα αντιδραστήριο σε προϊόν. Επομένως, η ενέργεια ενεργοποίησης ισούται με τη δυναμική ενέργεια της μεταβατικής κατάστασης μιας χημικής αντίδρασης.
Σχέση μεταξύ ενεργοποιημένου συμπλέγματος και κατάστασης μετάβασης
- Όταν υπάρχει μόνο ένα ενδιάμεσο μόριο σε μια χημική αντίδραση, το ενεργοποιημένο σύμπλοκο και η μεταβατική κατάσταση είναι ίδια.
Διαφορά μεταξύ ενεργοποιημένου συμπλέγματος και κατάστασης μετάβασης
Ορισμός
Ενεργοποιημένο σύμπλεγμα: Το ενεργοποιημένο σύμπλεγμα αναφέρεται σε μια συλλογή ενδιάμεσων μορίων που σχηματίζονται κατά την εξέλιξη μιας χημικής αντίδρασης.
Μεταβατικό κράτος: Η μεταβατική κατάσταση είναι το ενδιάμεσο μιας χημικής αντίδρασης που περιλαμβάνει την υψηλότερη δυναμική ενέργεια.
Δυνητική ενέργεια
Ενεργοποιημένο σύμπλεγμα: Το ενεργοποιημένο σύμπλεγμα έχει υψηλή δυναμική ενέργεια από τα αντιδρώντα.
Μεταβατικό κράτος: Η κατάσταση μετάβασης έχει την υψηλότερη δυναμική ενέργεια μεταξύ άλλων ενδιάμεσων δομών.
Σχηματισμός προϊόντος
Ενεργοποιημένο σύμπλεγμα: Το ενεργοποιημένο σύμπλοκο μπορεί να σχηματίσει το τελικό προϊόν της αντίδρασης ή μπορεί να πάει προς τα πίσω σχηματίζοντας αντιδρώντα χωρίς να δώσει προϊόντα.
Μεταβατικό κράτος: Η μεταβατική κατάσταση έχει μεγάλη πιθανότητα να σχηματιστεί το προϊόν αντί να σχηματιστούν ξανά τα αντιδρώντα.
Συμπέρασμα
Ορισμένες χημικές αντιδράσεις συμβαίνουν μέσω πολλών βημάτων. Υπάρχουν τρία κύρια στάδια:αρχικό στάδιο με αντιδρώντα, μεταβατική κατάσταση με ενδιάμεσα μόρια και τελικό στάδιο με προϊόντα. Το ενεργοποιημένο σύμπλοκο και η μεταβατική κατάσταση είναι δύο όροι που εξηγούνται σχετικά με αυτόν τον τύπο χημικών αντιδράσεων. Η κύρια διαφορά μεταξύ ενεργοποιημένου συμπλέγματος και μεταβατικής κατάστασης είναι ότι το σύμπλοκο ενεργοποίησης αναφέρεται σε όλα τα πιθανά ενδιάμεσα ενώ η κατάσταση μετάβασης αναφέρεται στο ενδιάμεσο με την υψηλότερη δυναμική ενέργεια.