Επεξήγηση Heat of Fusion
Βασικές έννοιες
Σε αυτό το άρθρο, θα μάθετε για τη θερμότητα της σύντηξης, συμπεριλαμβανομένης της θερμοδυναμικής και των εφαρμογών της. Μετά από αυτό το άρθρο, θα μπορείτε να κατανοήσετε τη φύση της θερμότητας της σύντηξης καθώς και να τη χρησιμοποιήσετε για να λύσετε προβλήματα θερμοχημείας.
Τι είναι το Heat of Fusion;
Η θερμότητα σύντηξης, που ονομάζεται επίσης ενθαλπία σύντηξης ή λανθάνουσα θερμότητα σύντηξης, είναι μια ποσότητα ενέργειας που απαιτείται για την τήξη ή την κατάψυξη μιας ουσίας υπό συνθήκες σταθερής πίεσης. Όταν μελετάτε τη χημεία, η «σύντηξη» έχει απλώς τον ίδιο ορισμό με το λιώσιμο. Στην τάξη, χρησιμοποιείτε κυρίως θερμότητα σύντηξης όταν μια ουσία βρίσκεται στο σημείο τήξης ή στο σημείο πήξης της. Σε τέτοιες περιπτώσεις, οι περισσότεροι θεωρούν τη θερμότητα σύντηξης ως σταθερά.
Για παράδειγμα, το νερό έχει θερμότητα σύντηξης 334 J/g στο σημείο τήξης του 0°C. Αυτό σημαίνει ότι, στους 0°C, ένα γραμμάριο υγρού νερού πρέπει να απελευθερώσει 334 Joules ενέργειας για να παγώσει εντελώς σε πάγο. Επίσης, ένα γραμμάριο πάγου πρέπει να απορροφήσει 334 Joules ενέργειας για να λιώσει τελείως στους 0°C.
Μπορείτε να υπολογίσετε την ποσότητα της θερμικής ενέργειας που απαιτείται για την αλλαγή της φάσης μιας ουσίας στο σημείο τήξης της χρησιμοποιώντας την ακόλουθη εξίσωση θερμότητας σύντηξης:
q =m∆Hf
q:Συνολική μεταβολή της θερμικής ενέργειας (σε Joules)
∆Hf:Θερµότητα σύντηξης ουσίας (σε Joules ανά γραµµάριο)
m:Μάζα ουσίας (σε γραμμάρια)
Μοριακή θερμότητα σύντηξης
Εάν γνωρίζετε τη μοριακή μάζα της ουσίας, μπορείτε εύκολα να τη μετατρέψετε σε μοριακή θερμότητα σύντηξης. Το νερό έχει μοριακή μάζα 18,02 g/mol, επομένως η γραμμομοριακή του θερμότητα σύντηξης θα ήταν 6020 J/mol (334*18,02 =6020). Συνεπώς, για να υπολογίσετε τη συνολική μεταβολή της ενέργειας, θα έπρεπε αντ 'αυτού να χρησιμοποιήσετε κρεατοελιές αντί για μάζα:
q =n∆Hf
n:Moles of ουσία
Η θερμότητα της σύντηξης έχει ενδιαφέρει χημικούς και φυσικούς επειδή υποδηλώνει ότι μια ουσία μπορεί να απορροφήσει ή να απελευθερώσει ενέργεια χωρίς να αλλάξει τη θερμοκρασία. Πράγματι, όταν ένα mole πάγου στους 0°C απορροφά 6020 Joules θερμότητας, το υγρό νερό που προκύπτει θα έχει επίσης θερμοκρασία 0°C. Για να κατανοήσουμε την ιδιαιτερότητα αυτού του φαινομένου, πρέπει πρώτα να μιλήσουμε για ενεργειακές αλλαγές που δεν συνεπάγονται αλλαγή φάσης.
Πώς αλλάζουν συνήθως οι ουσίες στη θερμοκρασία;
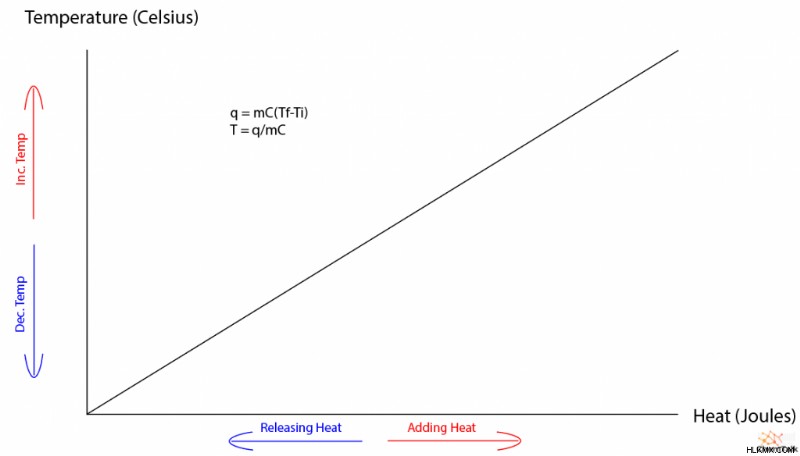
Τυπικά, όταν μια ουσία απορροφά ή απελευθερώνει θερμική ενέργεια, η θερμοκρασία της στη συνέχεια αλλάζει ως απόκριση. Η ποσότητα της αλλαγής θερμοκρασίας διέπεται από την ειδική θερμότητα της ουσίας, η οποία είναι μια εγγενής ποιότητα μιας ουσίας και δεν εξαρτάται από την ποσότητα της ουσίας που έχετε. Η ακόλουθη εξίσωση περιγράφει λεπτομερώς τη σχέση μεταξύ θερμικής ενέργειας, ειδικής θερμότητας και θερμοκρασίας.
q =mC∆T
q:Αλλαγή στη θερμότητα (σε Joules)
m:Μάζα της ουσίας (σε γραμμάρια)
Γ:Ειδική θερμότητα ουσίας (σε Joules ανά γραμμάριο ανά βαθμό Κελσίου)
ΔT:Αλλαγή θερμοκρασίας (σε βαθμούς Κελσίου)
Με αυτόν τον τρόπο, μπορείτε να σκεφτείτε την ειδική θερμότητα ως την ποσότητα ενέργειας που απαιτείται για να αλλάξει ένα γραμμάριο θερμοκρασίας μιας ουσίας κατά ένα βαθμό Κελσίου. Για παράδειγμα, η ειδική θερμότητα του χρυσού είναι 0,128 J/g°C. Αυτό σημαίνει ότι ένα γραμμάριο καθαρού χρυσού θερμαίνεται κατά 1°C όταν απορροφά 0,128 Joules ενέργειας. Αντίθετα, όταν εξάγονται 0,128 Joules ενέργειας από τον χρυσό, η θερμοκρασία του μειώνεται κατά 1°C. Για να μάθετε περισσότερα σχετικά με τον τρόπο χρήσης της ειδικής θερμότητας, ανατρέξτε σε αυτό το άρθρο.
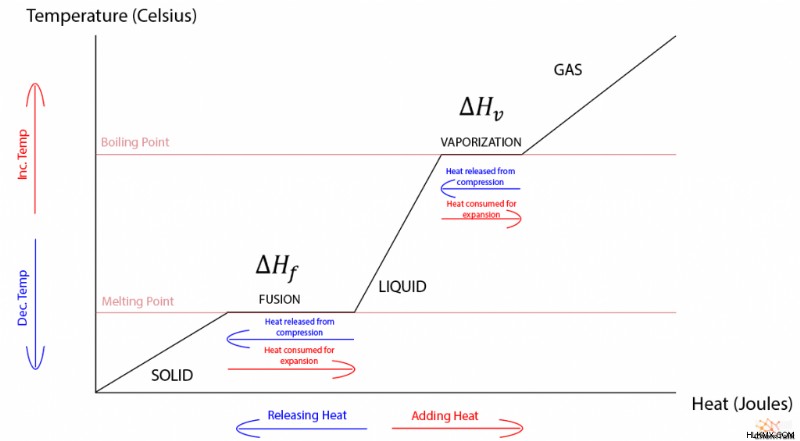
Δεδομένου ότι η θερμοκρασία και η θερμότητα έχουν μια ευθέως αναλογική σχέση, ένα γράφημα θερμότητας έναντι θερμοκρασίας μιας ουσίας χωρίς αλλαγές φάσης είναι γραμμικό. Όταν το γράφημα περιλαμβάνει αλλαγές φάσης, εμφανίζεται μια παράξενη κομματιασμένη κλίση με επίπεδες εκτάσεις που αντιστοιχούν σε τήξη και εξάτμιση. Ως δευτερεύουσα σημείωση, η αλλαγή φάσης μεταξύ αερίου και υγρού διέπεται από μια «θερμότητα εξάτμισης» που λειτουργεί πανομοιότυπα με τη θερμότητα σύντηξης.
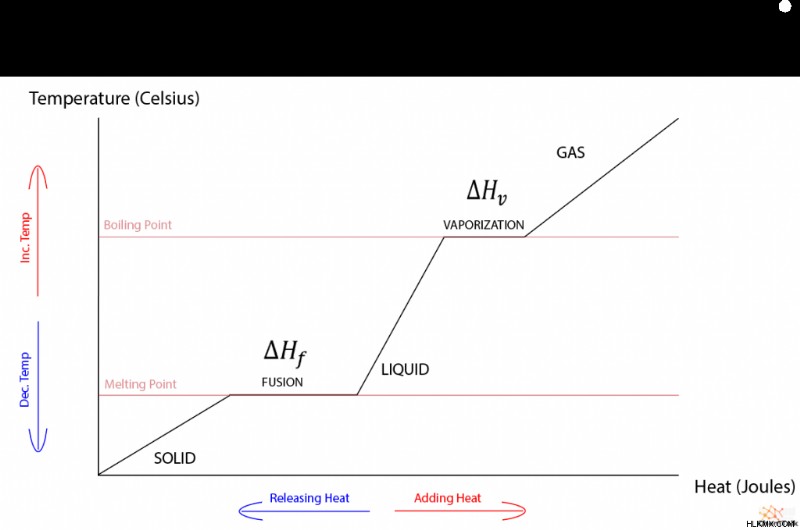
Λοιπόν, δεδομένου ότι η θερμοκρασία και η θερμική ενέργεια έχουν συνήθως μια άμεση σχέση, γιατί η θερμοκρασία δεν αλλάζει κατά τις μεταβάσεις φάσης; Για να καταλάβουμε γιατί, πρέπει να διερευνήσουμε τη θερμοδυναμική των μεταπτώσεων φάσης.
Η Θερμοδυναμική πίσω από τη θερμότητα της σύντηξης
Θερμοκρασία και Εσωτερική ενέργεια
Αρχικά, πρέπει να μιλήσουμε για το τι σημαίνει πραγματικά η «θερμοκρασία». Οι χημικοί και οι φυσικοί ορίζουν τη θερμοκρασία ως τη μέση κινητική ενέργεια ανά μόριο μιας ουσίας. Η κινητική ενέργεια εξαρτάται από τη μάζα και την ταχύτητα ενός σωματιδίου. Επειδή η θέρμανση μιας ουσίας δεν συνεπάγεται αλλαγές στη μοριακή μάζα, αλλάζει μόνο η ταχύτητα των μορίων. Έτσι, όταν μια ουσία απορροφά θερμική ενέργεια, τα μόριά της κινούνται γρηγορότερα, υποδηλώνοντας αυξημένη θερμοκρασία.
Είναι σημαντικό ότι η θερμοκρασία ενός συστήματος είναι ανάλογη με μια ποσότητα που ονομάζεται εσωτερική ενέργεια του συστήματος. Έτσι, τυχόν αλλαγές στη θερμοκρασία ενός συστήματος θα συνεπάγονται παρόμοια αλλαγή στην εσωτερική του ενέργεια.
Ο πρώτος νόμος της θερμοδυναμικής δηλώνει ότι οποιαδήποτε αλλαγή στην εσωτερική ενέργεια ενός συστήματος () ισούται με το άθροισμα της θερμότητας που εκπέμπεται ή απορροφάται και της εργασίας που γίνεται από ή πάνω στο σύστημα:
∆U =q + w
∆U:Εσωτερική ενέργεια. θετικό για την αύξηση της θερμοκρασίας, αρνητικό για τη μείωση της θερμοκρασίας (σε Joules)
q:Θερμότητα; θετικό για απορρόφηση θερμότητας, αρνητικό για θερμότητα που απελευθερώνεται (σε Joules)
w:Εργασία; θετικό για την εργασία που γίνεται στο σύστημα, αρνητικό για το έργο που εκτελείται από το σύστημα (σε Joules
Εργασία
Γενικά, όταν ασχολούμαστε με κάποια ουσία σε ένα δοχείο, η μόνη εργασία που μπορεί να εκτελέσει η ουσία είναι εργασίες διαστολής ή συμπίεσης. Αυτό περιλαμβάνει την αλλαγή του όγκου της ουσίας με ή ενάντια σε μια εξωτερική πίεση. Ωστόσο, μόνο τα αέρια μπορούν να πραγματοποιήσουν σημαντική διαστολή ή συμπίεση και η θερμότητα δρα αντίθετα για να διατηρήσει την εσωτερική ενέργεια του αερίου. Για παράδειγμα, όταν θερμαίνεται ένα αέριο (θετική θερμότητα), το αέριο θα διαστέλλεται (αρνητικό έργο), με αποτέλεσμα να μην αλλάζει η εσωτερική ενέργεια. Επιπλέον, κατά τη συμπίεση ενός αερίου (θετικό έργο), το αέριο θα απελευθερώσει θερμική ενέργεια (αρνητική θερμότητα).
Σε αντίθεση με τα αέρια, τα υγρά και τα στερεά δεν αλλάζουν πολύ σε όγκο όταν θερμαίνονται ή ψύχονται. Όταν ένα υγρό ή αέριο θερμαίνεται ή ψύχεται, ουσιαστικά δεν εκτελείται καμία εργασία. Έτσι, οποιαδήποτε θερμότητα απορροφάται αυξάνει την εσωτερική ενέργεια της ουσίας, αυξάνοντας τη θερμοκρασία της.
Ωστόσο, τα υγρά και τα στερεά υφίστανται μη μηδενική εργασία όταν αλλάζουν φάσεις. Αυτό συμβαίνει επειδή τα μόρια είναι συχνά πιο κοντά μεταξύ τους σε στερεή μορφή παρά σε υγρή μορφή. Ως αποτέλεσμα, ένα στερεό που λιώνει σε υγρό πρέπει να εκτονωθεί και ένα υγρό πρέπει να συμπιεστεί για να στερεοποιηθεί.
Αυτό το φαινόμενο εξηγεί με ακρίβεια τη φύση της θερμότητας της σύντηξης. Μόλις ένα στερεό θερμανθεί μέχρι το σημείο τήξεώς του, οποιαδήποτε περαιτέρω θερμική ενέργεια που εισάγεται στο στερεό χρησιμοποιείται για να διασταλεί σε υγρό. Έτσι, η θερμότητα και το έργο της ουσίας αλληλοεξουδετερώνονται, με αποτέλεσμα να μην αλλάζει η εσωτερική ενέργεια, επιτρέποντας στην ουσία να παραμείνει στο σημείο τήξης της μέχρι να γίνει εντελώς υγρή.