Είναι το διοξείδιο του άνθρακα (CO2) πολικό ή μη πολικό;
Ίσως έχετε ακούσει ότι το νερό είναι ένα πολικό μόριο, αλλά τι γίνεται με το διοξείδιο του άνθρακα ? Είναι πολικό ή μη πολικό ? Το διοξείδιο του άνθρακα θεωρείται μη πολικό μόριο επειδή έχει συμμετρική δομή, με τα δύο άτομα οξυγόνου που βρίσκονται σε αυτό να μεταβάλλουν την πυκνότητα ηλεκτρονίων του άνθρακα με τον ίδιο ακριβώς τρόπο. Αυτή είναι η σύντομη απάντηση σχετικά με τη μη πολικότητα του διοξειδίου του άνθρακα.
Ωστόσο, θα ήταν καλό να ενσωματωθούν τα μη πολικά χαρακτηριστικά του διοξειδίου του άνθρακα με άλλα πολικά μόρια και να υπεισέλθουμε σε λεπτομέρειες σχετικά με το πώς αποφασίζεται η πολικότητα ενός μορίου.
Ορισμός της πολικότητας σε σχέση με το CO2
Τα πολικά μόρια είναι μόρια που έχουν περιοχές/περιοχές θετικού και αρνητικού φορτίου. Έχουν «πόλους», όπως ακριβώς οι απέναντι πόλους στη Γη, ή όπως τα θετικά και αρνητικά άκρα μιας μπαταρίας. Έτσι, εάν υπάρχουν θετικές και αρνητικές περιοχές του μορίου, το μόριο λέγεται ότι είναι πολικό - ότι έχει πολικότητα.
Ένα από τα πιο διάσημα παραδείγματα πολικών μορίων είναι το νερό. Το νερό έχει μια λυγισμένη δομή σε αυτό και τα δύο άτομα υδρογόνου που είναι συνδεδεμένα με το άτομο οξυγόνου έχουν ένα ελαφρύ θετικό φορτίο. Εν τω μεταξύ, το άλλο άκρο του ατόμου - το μόριο του οξυγόνου - έχει ένα ελαφρύ αρνητικό φορτίο και αυτά τα δύο φορτία δίνουν στο νερό την πολικότητα του.
Όπως μπορείτε να μαντέψετε, τα μόρια που δεν έχουν διακριτές θετικές και αρνητικές περιοχές λέγονται απλώς «μη πολικά». Ένα παράδειγμα μη πολικού μορίου είναι το αιθάνιο – χημικός τύπος C2H6. Το αιθάνιο είναι ένα μη πολικό μόριο για δύο διαφορετικούς λόγους. Η συμμετρική δομή του μορίου βοηθά το μόριο να διατηρήσει μια ομοιόμορφη εξάπλωση της ηλεκτραρνητικότητας, επομένως δεν υπάρχει διαφορά στην ποσότητα ηλεκτραρνητικότητας μεταξύ των δύο ατόμων άνθρακα και πολύ μικρή διαφορά στην ηλεκτραρνητικότητα μεταξύ των ατόμων υδρογόνου και των ατόμων άνθρακα. Αν και η συμμετρική φύση του αιθανίου δεν εγγυάται ότι θα είναι μη πολικό, βοηθάει στο να διατηρούνται οι περιοχές απαλλαγμένες από οποιαδήποτε αξιοσημείωτη χρέωση. Τα περισσότερα αλκαλικά έχουν παρόμοια δομή και αυτός είναι ένας από τους λόγους που συνήθως λέγεται ότι τα αλκαλικά στοιχεία είναι μη πολικά.
Στη χημεία υπάρχει η έννοια ότι «όπως διαλύει όμοια», που σημαίνει ότι η διαλυτότητα ενός μορίου είναι μεγαλύτερη όταν βρίσκεται σε παρόμοια ουσία. Οι μη πολικές χημικές ουσίες διαλύονται πιο εύκολα όταν συνδυάζονται μεταξύ τους και αυτό ισχύει και για τις πολικές χημικές ουσίες.
Πώς οι περιοχές γίνονται θετικές και αρνητικές;
Η πολικότητα ενός μορίου συμβαίνει ως αποτέλεσμα της μετατόπισης των ηλεκτρονίων. Τα ηλεκτρόνια θα κινηθούν προς μια συγκεκριμένη κατεύθυνση, επηρεάζοντας το θετικό/αρνητικό ισοζύγιο σε μια περιοχή του μορίου. Ο τρόπος με τον οποίο κινούνται αυτά τα ηλεκτρόνια εξαρτάται από τους δεσμούς που βρίσκονται μεταξύ των μορίων, καθώς οι δεσμοί περιέχουν επίσης ηλεκτρόνια και μπορεί να έχουν πολικότητα.
Εάν και τα δύο άτομα που σχηματίζουν έναν δεσμό είναι διαφορετικά, τότε ο δεσμός μεταξύ των ατόμων ταξινομείται ως πολικός. Δύο διαφορετικά άτομα που σχηματίζουν έναν δεσμό σημαίνει ότι οι πυρήνες των ατόμων έχουν διαφορετικές ικανότητες να προσελκύουν τα ηλεκτρόνια στον δεσμό και η θέση των ηλεκτρονίων θα μετατοπιστεί. Οι δεσμοί που έχουν τους ίδιους τύπους ατόμων που τους αποτελούν είναι μη πολικοί και δεν επιτρέπουν στα ηλεκτρόνια εντός του δεσμού να μετατοπιστούν, επειδή οι πυρήνες και των δύο ατόμων θα προσκολληθούν σφιχτά στα ηλεκτρόνια που έχουν.
Όλα αυτά σημαίνουν ότι το άτομο με τη μεγαλύτερη ικανότητα να έλκει ηλεκτρόνια προς το μέρος του θα γίνει ελαφρώς πιο αρνητικό λόγω του μεγαλύτερου αριθμού ηλεκτρονίων γύρω του. Αυτό δημιουργεί μια αρνητική περιοχή και μια θετική περιοχή και κάνει τον δεσμό πολικό στη φύση. Ένας άλλος τρόπος σκέψης για αυτό είναι ότι τα ηλεκτρόνια που αποτελούν μέρος ενός πολικού δεσμού θα συγκεντρωθούν προς το ένα ή το άλλο άκρο του δεσμού. Αυτό σημαίνει ότι ένας από τους δεσμούς θα έχει ένα ελαφρύ θετικό φορτίο ενώ το άλλο άκρο του δεσμού θα έχει ένα φορτίο ελαφρώς αρνητικού χαρακτήρα.
Γιατί το διοξείδιο του άνθρακα δεν είναι πολικό;

Μια αξιοσημείωτη πτυχή των πολικών/μη πολικών δεσμών είναι ότι όσο μεγαλύτερη είναι η ηλεκτραρνητική διαφορά μεταξύ των δύο ατόμων τόσο περισσότερο ο δεσμός μεταξύ των δύο μορίων θα είναι πολικός. Για παράδειγμα, οι άνθρακες εντός καρβονυλικών ομάδων έχουν ένα ελαφρύ θετικό φορτίο που κάνει τις καρβονυλικές ενώσεις να έχουν θετική περιοχή. Δεδομένων αυτών των πτυχών της μη πολικής/πολικής σχέσης με τους δεσμούς ηλεκτρονίων, γιατί το διοξείδιο του άνθρακα, το οποίο έχει δύο μερικώς αρνητικά άτομα οξυγόνου, δεν έχει πολική φύση;
Όλοι οι δεσμοί μέσα σε ένα μόριο πρέπει να λαμβάνονται υπόψη κατά τον προσδιορισμό της πολικότητας ενός μορίου. Εξετάζοντας την καθαρή επίδραση των δεσμών στο διοξείδιο του άνθρακα θα αποκαλυφθεί γιατί το μόριο είναι μη πολικό μόριο.
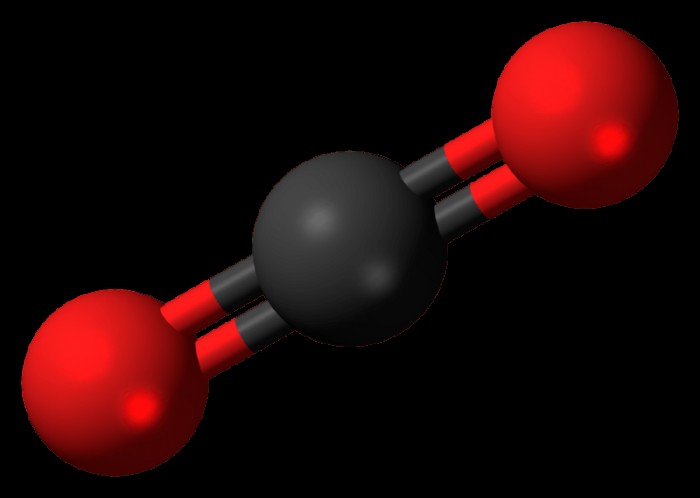
Ο χημικός τύπος για το διοξείδιο του άνθρακα είναι CO2 και οι δεσμοί στο μόριο μπορούν να αναπαρασταθούν ως εξής:
O =C =O
Όπως γίνεται φανερό όταν εξετάζουμε ένα διάγραμμα διοξειδίου του άνθρακα, το άτομο άνθρακα στη μέση έχει δύο δεσμούς με το οξυγόνο, καθένας από αυτούς δεσμεύει έναν διπλό δεσμό. Εφόσον είναι αλήθεια ότι το οξυγόνο έχει μεγαλύτερη ηλεκτραρνητική ισχύ από τον άνθρακα, θα πίστευε κανείς ότι οι δεσμοί μεταξύ οξυγόνου και άνθρακα θα έβλεπαν τα ηλεκτρόνια να έλκονται προς το οξυγόνο και το μόριο να γίνει πολικό.
Ωστόσο, λόγω της δομής του μορίου, διατηρεί μια μη πολική κατάσταση. Το μόριο είναι δομημένο έτσι ώστε και οι δύο διπλοί δεσμοί να βρίσκονται σε γραμμική διάταξη με το μόριο άνθρακα, σε γωνία 180 μοιρών ως προς το άτομο άνθρακα στο κέντρο. Αυτή η γραμμική δομή δημιουργεί μια κατάσταση όπου ακόμη και όταν ένα από τα άτομα οξυγόνου προσπαθεί να τραβήξει ηλεκτρόνια από το άτομο άνθρακα, το άλλο άτομο οξυγόνου έλκει τα ηλεκτρόνια του άνθρακα με ισοδύναμη δύναμη. Αυτές οι δυνάμεις ακυρώνουν η μία την άλλη και το αποτέλεσμα είναι ότι αν και και τα δύο άτομα οξυγόνου έλκουν τα ηλεκτρόνια, κανένα από τα ηλεκτρόνια στο μόριο δεν μετατοπίζει πραγματικά καθόλου θέσεις. Αυτό σημαίνει ότι δεν υπάρχει περιοχή του μορίου που να γίνεται υπερβολικά αρνητική ή θετική και ως αποτέλεσμα, το μόριο είναι μη πολικό.




