Λειτουργική Ομάδα Αλκοόλ
Βασικές έννοιες
Το αλκοόλ είναι μια λέξη που είναι γνωστή τόσο στους οργανικούς χημικούς όσο και στον μέσο άνθρωπο. Σε αυτό το άρθρο, θα επικεντρωθούμε στη χρήση της λέξης στην οργανική χημεία. Θα μάθετε τη δομή του αλκοόλ, την ταξινόμησή του, την ονοματολογία του και μερικές από τις αντιδράσεις του. Θα μπορέσετε επίσης να εξερευνήσετε πολλά παραδείγματα αλκοολών και τις χρήσεις τους στον πραγματικό κόσμο!
Θέματα που καλύπτονται σε άλλα άρθρα
- Λειτουργικές ομάδες στην Οργανική Χημεία
- Πυρηνόφιλο – Τι είναι;
- Αντίδραση Sn1
- Αντίδραση Sn2
- Αντίδραση E1
- Αντίδραση E2
Δομή του αλκοόλ
Οι αλκοόλες είναι ενώσεις με μια ομάδα υδροξυλίου (ομάδα ΟΗ) συνδεδεμένη με ένα sp υβριδισμένο άτομο άνθρακα. Δηλαδή, ο άνθρακας με το ΟΗ συνδέεται με τρία άλλα πράγματα που είναι είτε άτομα υδρογόνου είτε αλκυλομάδες είτε και τα δύο. Αυτό κάνει την αλκοόλη διαφορετική από το καρβοξυλικό οξύ, μια άλλη κοινή λειτουργική ομάδα που περιέχει υδροξυλικό οξύ, επειδή, στα καρβοξυλικά οξέα, ο άνθρακας με το ΟΗ συνδέεται διπλούς δεσμούς με ένα άλλο άτομο οξυγόνου.
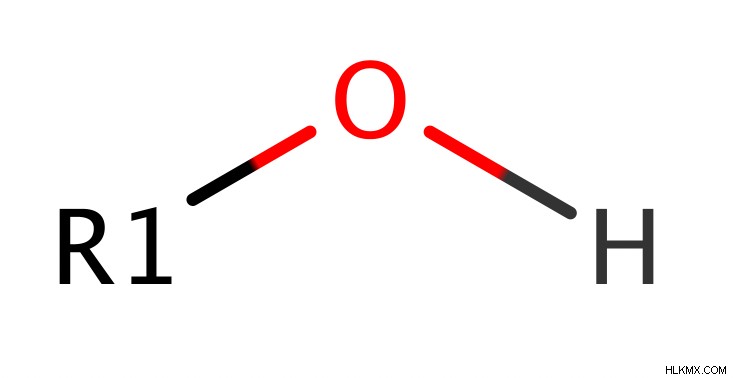
Ταξινόμηση του αλκοόλ s
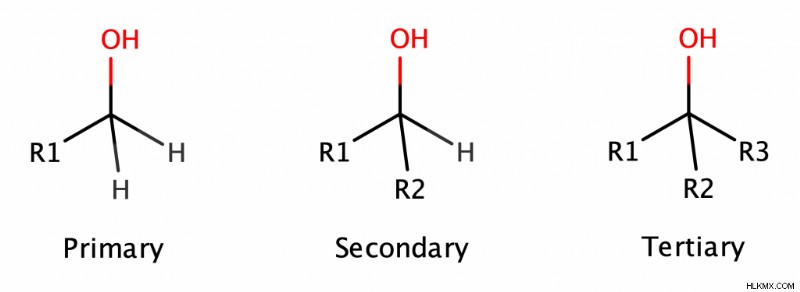
Η ταξινόμηση των αλκοολών εξαρτάται από το πόσες αλκυλομάδες είναι συνδεδεμένες στο άτομο άνθρακα με την ομάδα ΟΗ. Έχοντας αυτό κατά νου, μια αλκοόλη μπορεί να ταξινομηθεί ως πρωτογενής, δευτερογενής ή τριτοταγής αλκοόλη.
Σε μια πρωτοταγή αλκοόλη, ο άνθρακας με την ομάδα ΟΗ έχει 1 αλκυλομάδα συνδεδεμένη με αυτόν. Σε μια δευτεροταγή αλκοόλη, ο αριθμός των συνδεδεμένων αλκυλομάδων είναι 2. Και, το μαντέψατε, αυτός ο αριθμός είναι 3 στις τριτοταγείς αλκοόλες.
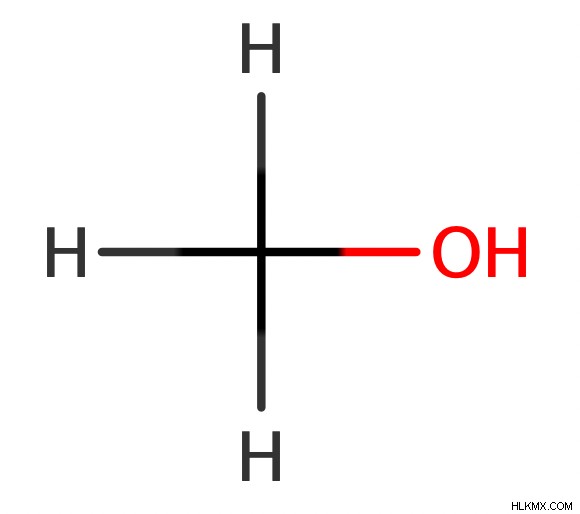
Παρεμπιπτόντως, οι χημικοί υπολογίζουν τη μεθανόλη ως πρωτοταγή αλκοόλη παρόλο που δεν έχει αλκυλομάδες που συνδέονται με τον άνθρακα με το ΟΗ.
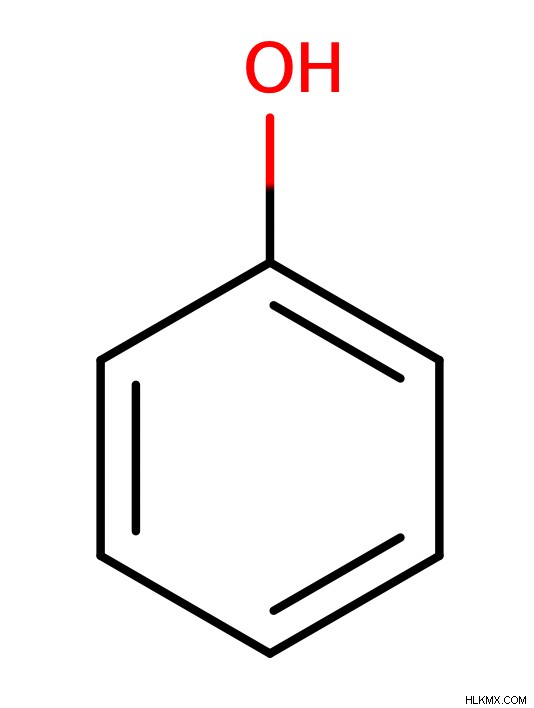
Φαινόλη
Η φαινόλη είναι ένα ειδικό είδος αλκοόλ. Το όνομα «φαινόλη» αναφέρεται τόσο στην οικογένεια των μορίων με μια ομάδα ΟΗ συνδεδεμένη σε έναν αρωματικό δακτύλιο όσο και στο απλούστερο μέλος αυτής της οικογένειας, C6 H5 OH. Οι φαινόλες έχουν μια σειρά από χαρακτηριστικά που διαφέρουν πολύ από τις κανονικές αλκοόλες. Για παράδειγμα, χάρη στην ικανότητά τους να σχηματίζουν δομές συντονισμού, οι φαινόλες είναι πολύ πιο όξινες από τις κανονικές αλκοόλες. Έτσι, η αντιδραστικότητα των φαινολών είναι διαφορετική από τις κανονικές αλκοόλες, επιτρέποντάς τους να συμμετέχουν σε αντιδράσεις που συνήθως δεν συμμετέχουν οι κανονικές αλκοόλες. Αυτός είναι ο λόγος που δεν θα εστιάσουμε υπερβολικά στις φαινόλες σε αυτό το άρθρο.
Γρήγορες πληροφορίες για τα αλκοόλ
- Δομή:Ένας απλός άνθρακας συνδεδεμένος με ένα οξυγόνο που είναι απλός δεσμός με ένα υδρογόνο
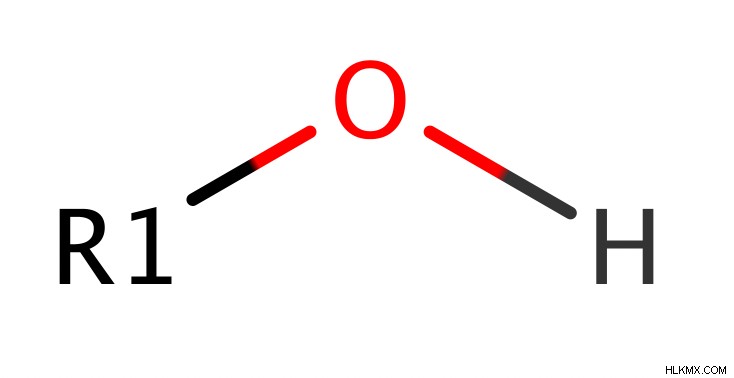
- Γενικός τύπος:R-OH ή ROH
- pH:Ουδέτερο (περίπου 7). Οι αλκοόλες είναι γενικά ασθενή οξέα των οποίων το πιο όξινο πρωτόνιο είναι το Η του ΟΗ.
- pKa:Γενικά από 15 έως 20
- Μεθανόλη (CH3 OH):15,3
- Αιθανόλη (C2 H5 OH):15,9
- Φαινόλη (C6 H5 OH):9,99
- Διαλυτότητα:Η διαλυτότητα μιας αλκοόλης σε πολικούς διαλύτες μειώνεται καθώς αυξάνεται το μέγεθος της υδρόφοβης περιοχής (συνήθως της υδρογονανθρακικής αλυσίδας) αυτής της αλκοόλης. Για παράδειγμα, η μεθανόλη και η αιθανόλη είναι αναμίξιμες στο νερό, ενώ η εννεανόλη είναι αδιάλυτη στο νερό.
- Φασματοσκοπία υπερύθρων:Ένα συμπυκνωμένο διάλυμα αλκοόλης παράγει ένα ευρύ σήμα περίπου 3200 – 3600 cm
Ονοματολογία αλκοόλ
Για να ονομάσετε ένα αλκοόλ χρησιμοποιώντας την ονοματολογία IUPAC, ακολουθήστε τα εξής βήματα:
- Πρώτα, προσδιορίστε τον γονέα, ο οποίος είναι η μεγαλύτερη αλυσίδα που περιέχει την ομάδα OH.
- Στη συνέχεια, αντιστοιχίστε έναν αριθμό στην ομάδα ΟΗ και άλλους υποκαταστάτες (εάν υπάρχουν) για να υποδείξουν τη θέση τους μέσα στο μόριο. Η ομάδα OH θα πρέπει να λάβει τον μικρότερο δυνατό αριθμό.
- Τέλος, αλλάξτε το επίθημα “-e” του μητρικού αλκανίου σε “-ol”.
Εάν ένα μόριο έχει πολλές ομάδες ΟΗ, εισάγετε προθέματα όπως "di" ή "tri" πριν από το "-ol". Σε τέτοιες περιπτώσεις, κρατήστε το "-e" του μητρικού αλκανίου.

Εάν το τμήμα αλκοόλης (πιο συγκεκριμένα, η ομάδα υδροξυλίου) είναι απλώς ένας υποκαταστάτης ενός μορίου (δηλαδή, υπάρχουν λειτουργικές ομάδες υψηλότερης προτεραιότητας), τότε βάζουμε το πρόθεμα «υδροξυ-» μπροστά από το μητρικό όνομα αυτού του μορίου.
Αντιδράσεις στο αλκοόλ
Γενικές τάσεις αντίδρασης
Το hotspot αντιδραστικότητας στις αλκοόλες είναι η ομάδα ΟΗ. Θα δείτε πολλές αντιδράσεις που περιλαμβάνουν την αφαίρεση ολόκληρης της ομάδας ΟΗ ή μόνο του Η. Η υψηλή ηλεκτραρνητικότητα του οξυγόνου κάνει το C και το H που συνδέονται με αυτό ηλεκτροφιλικά και επομένως αντιδρούν σε μόρια πλούσια σε ηλεκτρόνια.
Αλλά προτού προχωρήσουμε στις αντιδράσεις του αλκοόλ, ας δούμε πώς μπορεί κανείς να συνθέσει πρώτα το αλκοόλ.
Παρασκευή αλκοολών
Αντιδράσεις υποκατάστασης
Μπορούμε να παράγουμε αλκοόλες χρησιμοποιώντας είτε ένα SN 1 ή SN 2 αντίδραση αντικατάστασης. Ένα SN 1 αντίδραση συνήθως αποδίδει μια τριτοταγή αλκοόλη, ενώ μια SN 2 αντίδραση συνήθως αποδίδει μια πρωτοταγή αλκοόλη.
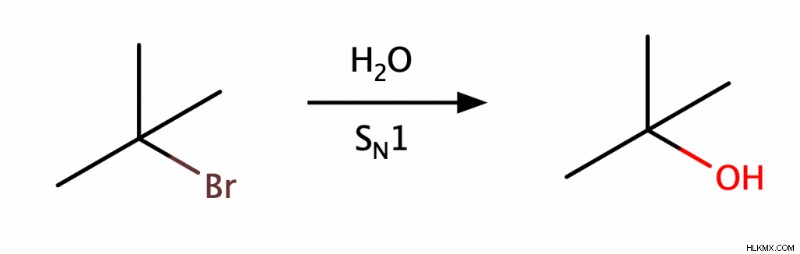
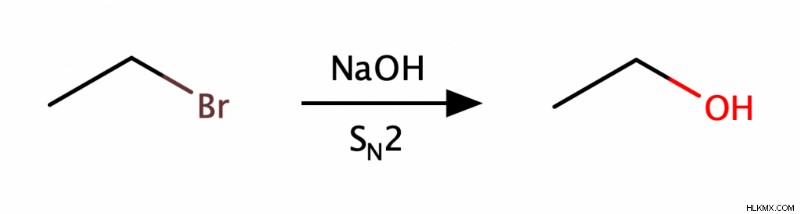
Αντιδράσεις προσθήκης
Τα αλκένια μπορούν να υποστούν ενυδάτωση για να παράγουν αλκοόλες. Μπορείτε να διαβάσετε περισσότερα για αυτές τις αντιδράσεις ενυδάτωσης στο άρθρο μας για τα αλκένια.
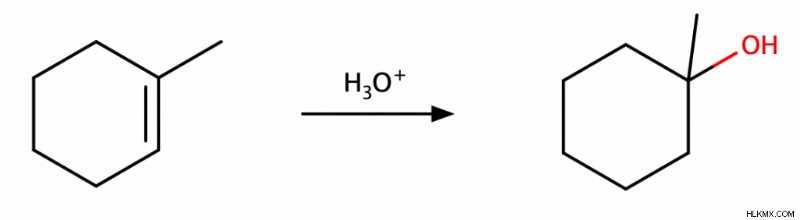
Αντιδράσεις μείωσης
Μπορούμε να αναγάγουμε τις αλδεΰδες ή τις κετόνες σε αλκοόλες με έναν αναγωγικό παράγοντα όπως το βοροϋδρίδιο του νατρίου (NaBH4 ) ή υδρίδιο λιθίου αργιλίου (LAH). Επιπλέον, η αντιδραστικότητα του LAH του επιτρέπει επίσης να μειώνει τα καρβοξυλικά οξέα και τους εστέρες σε αλκοόλες. Αυτοί οι αναγωγικοί παράγοντες δρουν ως πηγές πρωτονίων, δίνοντας τα πρωτόνια τους στο αντιδρόν.
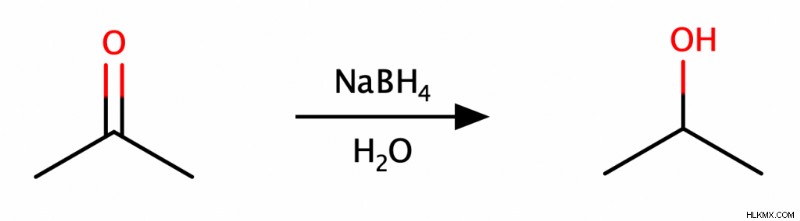
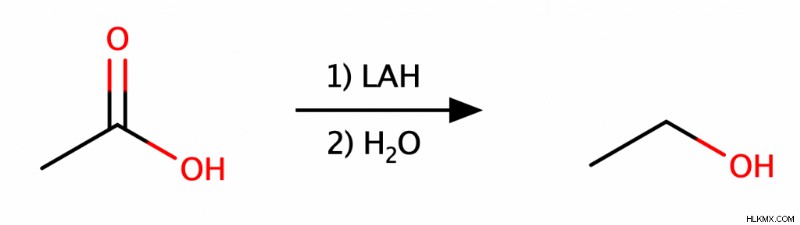
Αντιδραστήρια Grignard
Τα αντιδραστήρια Grignard είναι αλκυλαλογονίδια που υποβάλλονται σε επεξεργασία με μαγνήσιο. Ένα αντιδραστήριο Grignard έχει πυρηνόφιλο άνθρακα που μπορεί να εκτελεί επιθέσεις σε διάφορα ηλεκτρόφιλα και επομένως είναι χρήσιμο στην κατασκευή σκελετών άνθρακα. Στην περίπτωσή μας, οι αλδεΰδες, οι κετόνες και οι εστέρες μπορούν όλα να προσβληθούν από το αντιδραστήριο Grignard και να υποστούν επακόλουθη πρωτονίωση για να παράγουν αλκοόλες.
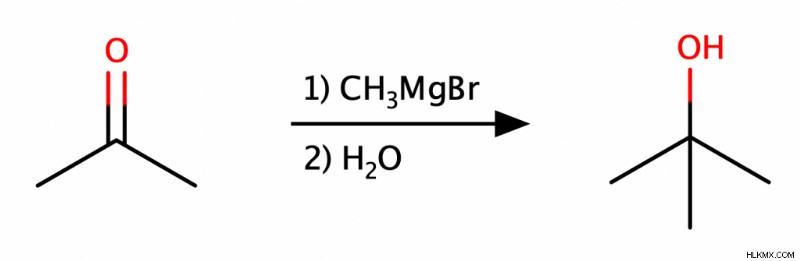
Αντιδράσεις των αλκοολών
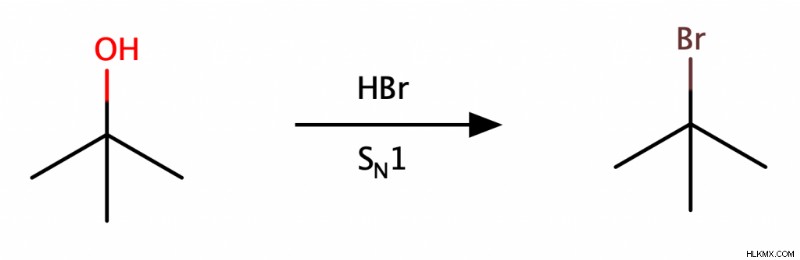
Αντιδράσεις υποκατάστασης
Οι αλκοόλες μπορούν να υποστούν αντιδράσεις υποκατάστασης για να σχηματίσουν αλκυλαλογονίδια. Οι τριτοταγείς αλκοόλες υφίστανται μόνο SN 1 αντιδράσεις; Οι δευτεροταγείς αλκοόλες μπορούν να υποστούν SN 1 αντιδράσεις αλλά με αργό ρυθμό και επομένως γενικά προτιμούν να υποβάλλονται σε SN 2 αντιδράσεις? Οι πρωτογενείς αλκοόλες υφίστανται μόνο SN 2 αντιδράσεις.
Είναι σημαντικό να σημειωθεί ότι εφόσον το ΟΗ είναι μια κακή αποχωρούσα ομάδα, η μετατροπή του ΟΗ σε μια καλύτερη αποχωρούσα ομάδα είναι ένα απαραίτητο βήμα στον μηχανισμό κάθε αντίδρασης υποκατάστασης αλκοόλης.
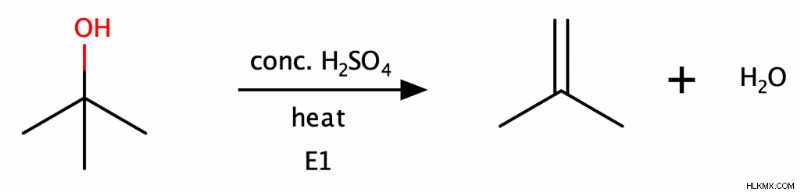
Αντιδράσεις εξάλειψης/αφυδάτωσης
Οι δευτεροταγείς και τριτοταγείς αλκοόλες μπορούν να υποστούν μια αντίδραση Ε1 για να σχηματίσουν αλκένια υπό όξινες συνθήκες. Δεδομένου ότι αυτή η αντίδραση αφαιρεί επίσης ένα μόριο νερού, οι χημικοί την αποκαλούν επίσης «αντίδραση αφυδάτωσης». Οι πρωτογενείς αλκοόλες μπορούν επίσης να υποστούν αντίδραση αφυδάτωσης μέσω ενός μηχανισμού Ε2, αλλά με πολύ πιο αργό ρυθμό από τις δευτεροταγείς και τριτοταγείς αλκοόλες.
Αντιδράσεις οξείδωσης
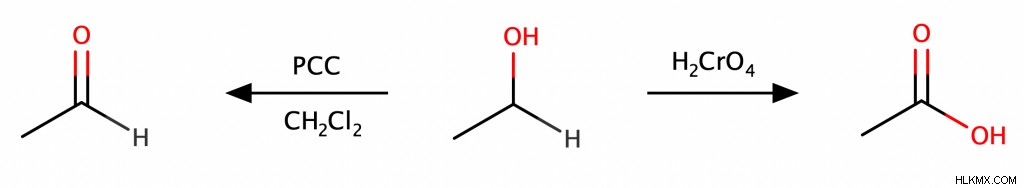
Οι πρωτογενείς αλκοόλες μπορούν να υποστούν οξείδωση για να παράγουν αλδεΰδες ή καρβοξυλικά οξέα. Μπορείτε να ελέγξετε το προϊόν επιλέγοντας προσεκτικά τον οξειδωτικό παράγοντα. Ένα ισχυρό οξειδωτικό όπως το χρωμικό οξύ (H2 CrO4 ) θα οξειδώσει την πρωτοταγή αλκοόλη κατευθείαν σε καρβοξυλικό οξύ, ενώ ένα ηπιότερο και πιο εκλεκτικό οξειδωτικό όπως το χλωροχρωμικό πυριδίνιο (συντομογραφία PCC) θα οξειδώσει μόνο την πρωτοταγή αλκοόλη σε αλδεΰδη.
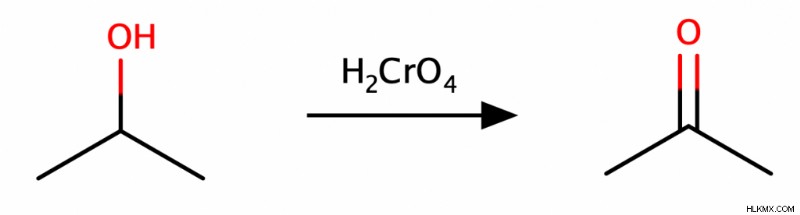
Οι δευτεροταγείς αλκοόλες θα παράγουν κετόνες μόνο κατά την οξείδωση και οι τριτοταγείς αλκοόλες δεν θα υποστούν καθόλου οξείδωση. (Για να καταλάβετε γιατί, θυμηθείτε ότι η αφαίρεση ενός ατόμου υδρογόνου είναι ο καλύτερος τρόπος για να αυξηθεί η κατάσταση οξείδωσης ενός μορίου. Δυστυχώς, στις τριτοταγείς αλκοόλες, ο άνθρακας με την ομάδα ΟΗ δεν συνδέεται με κανένα αφαιρούμενο άτομο υδρογόνου.)
Εστεροποίηση
Οι αλκοόλες μπορούν να αντιδράσουν με τα καρβοξυλικά οξέα παρουσία ενός καταλυτικού οξέος και να θερμανθούν για να παράγουν εστέρες. Οι χημικοί ονομάζουν αυτή την αντίδραση εστεροποίηση Fischer. Μπορείτε να μάθετε περισσότερα σχετικά με αυτό σε αυτό το άρθρο:Ester Functional Group and Esterification.
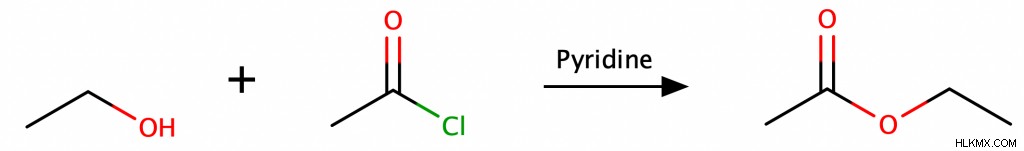
Οι αλκοόλες μπορούν επίσης να παράγουν εστέρες όταν αντιδρούν με όξινα χλωρίδια (ονομάζονται επίσης ακυλοχλωρίδια) παρουσία εξουδετερωτικής πυριδίνης.
Παραδείγματα αλκοολών
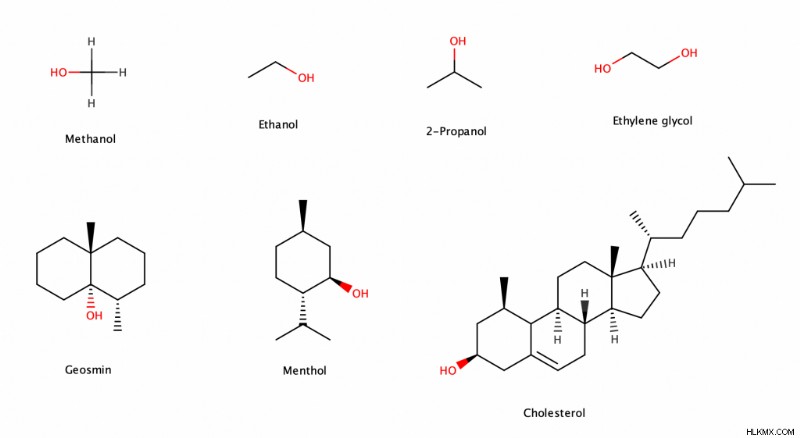
- Μεθανόλη (ή μεθυλική αλκοόλη ή αλκοόλη ξύλου) (CH3 OH) χρησιμοποιείται πιο συχνά για την παραγωγή καυσίμων για αυτοκίνητα και πλοία.
- Αιθανόλη (ή αιθυλική αλκοόλη) (C2 H5 OH) είναι το αλκοόλ που βρίσκεται στα αλκοολούχα ποτά. Διαφορετικοί τύποι ποτών έχουν διαφορετικές συγκεντρώσεις αιθανόλης. Για παράδειγμα, το ουίσκι έχει υψηλότερη συγκέντρωση αιθανόλης από τη σαμπάνια και η σαμπάνια έχει υψηλότερη συγκέντρωση αιθανόλης από την τυπική μπύρα.
- 2-προπανόλη (ή ισοπροπυλική αλκοόλη) ((CH3 )2 CHOH) χρησιμοποιείται στον καθαρισμό και την απολύμανση προϊόντων όπως απορρυπαντικά και απολυμαντικά χεριών.
- Αιθανο-1,2-διόλη (ή αιθυλενογλυκόλη) ((CH2 Ω)2 ) είναι το κύριο συστατικό του αντιψυκτικού.
- Geosmin (Γ12 H22 Ο) είναι μια δικυκλική αλκοόλη που δίνει στη βροχή την ξεχωριστή γήινη μυρωδιά της.
- Μενθόλη (Γ10 H20 O) είναι υπεύθυνη για τη μέντα, αναζωογονητική αίσθηση που δίνουν προϊόντα όπως η οδοντόκρεμα, το στοματικό διάλυμα και η τσίχλα.
- Χοληστερόλη (C27 H46 O) είναι ένας τύπος λιπιδίου που βοηθά το σώμα να δημιουργήσει κυτταρικές μεμβράνες, αρκετές ορμόνες, χολικό οξύ και βιταμίνη D.

Περαιτέρω αναγνώσεις
- Αντίδραση συμπύκνωσης Aldol
- Λειτουργική ομάδα αιθέρα
- Λειτουργική ομάδα θειόλης
- Εξαιρετικό μαγνήσιο




