Ταυτομερισμός κετοενόλης
Βασικές έννοιες
Σε αυτό το άρθρο, θα μάθετε για τον ταυτομερισμό κετοενόλης, συμπεριλαμβανομένης της έννοιας του «αυτομερισμού», των τάσεων στη σταθερότητα της ενόλης και σημαντικών μηχανισμών υπό όξινες και βασικές συνθήκες.
Τι είναι ο ταυτομερισμός κετοενόλης;
Ο ταυτομερισμός κετοενόλης είναι η αντίδραση μετατροπής μεταξύ των δομών μιας κετόνης και ενός μορίου ενόλης. Πριν προχωρήσουμε στον μηχανισμό μιας τέτοιας αντίδρασης, ας διευκρινίσουμε πρώτα την έννοια του "αυτομερισμού".
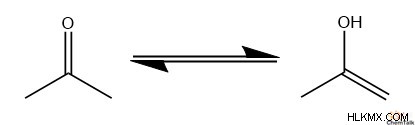
Οι χημικοί χρησιμοποιούν τον όρο «ταυτομερισμός» για να περιγράψουν τη διαδικασία δύο μοριακών δομών που αλληλομετατρέπονται κάτω από μια κατάσταση δυναμικής ισορροπίας. Συχνά, αυτό περιλαμβάνει την κίνηση κάποιας χημικής ομάδας μεταξύ δύο θέσεων σε ένα μόριο.
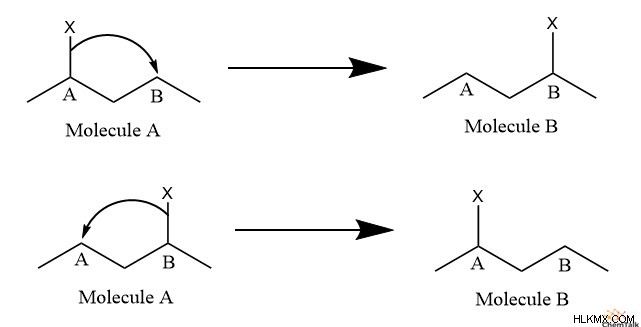
Με άλλα λόγια, ας υποθέσουμε ότι έχετε ένα Μόριο Α με κάποια λειτουργική ομάδα Χ. Στο Μόριο Α, η ομάδα Χ προσκολλάται στη θέση Α. Ωστόσο, υπάρχει μια άλλη κατάλληλη θέση για την προσάρτηση της ομάδας Χ, που ονομάζεται τοποθεσία Β. Μερικές φορές, η ομάδα Χ μετακινείται από θέση Α στη θέση Β, η οποία αλλάζει το Μόριο Α σε Μόριο Β, το ταυτομερές του. Μόλις βρεθεί στη θέση Β, η ομάδα Χ μπορεί επίσης να επιστρέψει στη θέση Α. Η κίνηση της ομάδας Χ μεταξύ θέσεων, μετατρέποντας τη μοριακή δομή, ονομάζεται ταυτομερισμός.
Όταν έχετε ένα ολόκληρο μάτσο Μόριο Α, όπως ένα μόριο διαλυμένο σε διαλύτη, θα μετατρέπεται συνεχώς σε Μόριο Β και πάλι πίσω. Ωστόσο, οι σχετικές αναλογίες του μορίου Α και του μορίου Β παραμένουν σταθερές, γιατί τελικά, οι ρυθμοί μετατροπής τους θα ακυρωθούν. Αυτό εννοούν οι χημικοί με τον όρο «δυναμική ισορροπία».
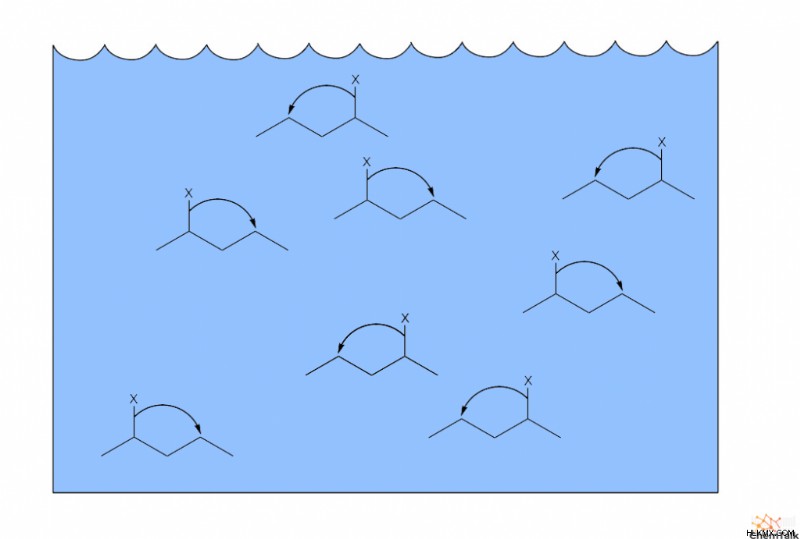
Συχνά, το Μόριο Α έχει μεγαλύτερη σταθερότητα από το Μόριο Β, που σημαίνει ότι το Μόριο Α υπερτερεί του Β στην ισορροπία. Αυτή η άνιση κατάσταση ισορροπίας εμφανίζεται συνήθως σε ζεύγη ταυτομερών, συμπεριλαμβανομένων μεταξύ κετονών και ενολών. Ωστόσο, στον ταυτομερισμό κετοενόλης, διαφορετικοί δομικοί παράγοντες καθορίζουν ποιο μόριο υπερτερεί του άλλου.
Δομή Tautomer Keto Enol
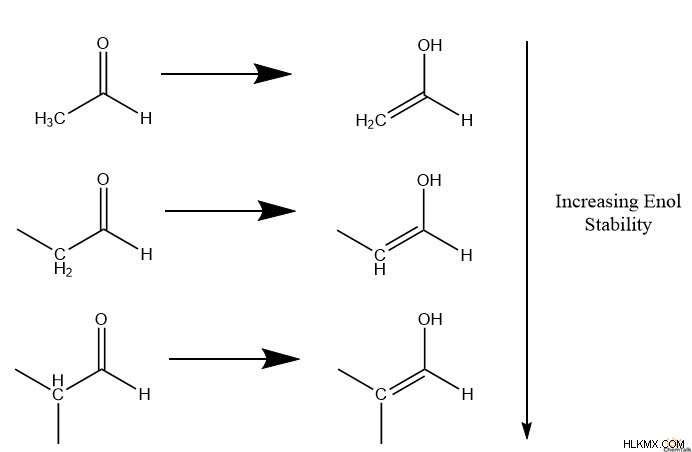
Γενικά, οι κετόνες ευνοούνται σε μεγάλο βαθμό έναντι των ενόλων σε πολλές από τις πιο κοινές μοριακές δομές. Ωστόσο, η δομή του ɑ-άνθρακα (ο άνθρακας που αφαιρέθηκε μόλις από το καρβονύλιο) μπορεί να αλλάξει την ευνοϊκότητα της κετόνης.
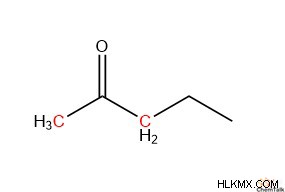
Μια τέτοια δομική τάση υποστηρίζει ότι οι ɑ-άνθρακες με περισσότερα μη υδρογόνα έχουν μεγαλύτερη σταθερότητα όπως οι ενόλες. Για παράδειγμα, εάν ο ɑ-άνθρακας έχει δομή μεθυλίου, με τρία υδρογόνα, έχει μικρότερη σταθερότητα σχηματίζοντας μια ενόλη από έναν άνθρακα ɑ-άνθρακα μεθυλενίου, ο οποίος έχει δύο υδρογόνα. Οι ενόλες που σχηματίζονται από μεθυλενικούς άνθρακες σταθεροποιούν τις ενόλες λιγότερο από τους μεθινικούς άνθρακες, οι οποίοι έχουν ένα υδρογόνο και δύο υδρογονάνθρακες.
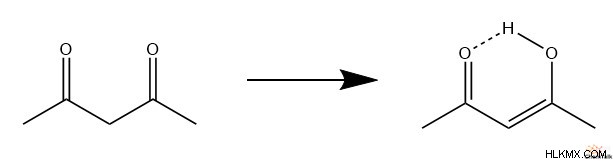
Ωστόσο, υπάρχουν μερικά μόρια στα οποία η μορφή ενόλης υπερισχύει της κετόνης. Ένα τέτοιο παράδειγμα είναι τα μόρια 1,3-δικαρβονυλίου, τα οποία συχνά σχηματίζονται από ορισμένες συμπυκνώσεις αλδόλης. Σε αυτά τα μόρια, μπορεί να σχηματιστεί μια ενόλη, ανακατεύοντας ένα υδρογόνο στο ιόν οξειδίου. Αυτή η νέα δομή υδροξειδίου σταθεροποιείται από το γειτονικό καρβονύλιο παρέχοντας έναν δεσμό υδρογόνου. Τελικά, αυτός ο συνδυασμός ενόλης-κετόνης σχηματίζει αυτήν την αυτοσταθεροποιούμενη δομή που έχει τον χαρακτήρα ενός εξαμελούς δακτυλίου.
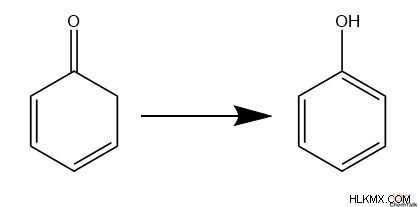
Οι αρωματικές ενόλες τείνουν επίσης να έχουν σταθερότητα, καθώς η αρωματικότητα προσφέρει τέτοια σταθερότητα που υπερτερεί των κετονών. Συγκεκριμένα, οι ενόλες ευνοούνται όταν το αλκένιο που προκύπτει συμπληρώνει έναν κύκλο αρωματικών ηλεκτρονίων. Αυτό εξηγεί γιατί οι φαινόλες τείνουν να σχηματίζουν σταθερές δομές, ενώ οι 2,4-κυκλοδιενόνες τείνουν να παραμένουν σπάνιες.
Μηχανισμός ταυτομερισμού κετοενόλης
Αυτομερισμός υπό όξινες συνθήκες
Ο ταυτομερισμός κετο-ενόλης υπό όξινες συνθήκες ουσιαστικά έχει πρωτονίωση που οδηγεί τη μετατροπή μεταξύ κετονών και ενολών.
Για να σχηματιστεί μια ενόλη, ένα οξύ πρωτονιώνει ένα μοναχικό ζεύγος ηλεκτρονίων στο καρβονύλιο. Στη συνέχεια, η συζευγμένη βάση του οξέος αποπρωτονιώνει τον α-άνθρακα. Αυτό οδηγεί σε μεταφορά ηλεκτρονίων, σχηματίζοντας τελικά μια ενόλη.
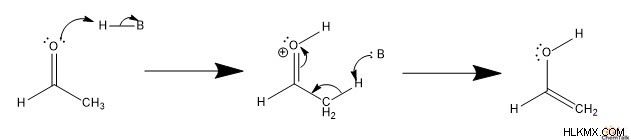
Για να σχηματιστεί μια κετόνη, το οξύ πρωτονιώνει το αλκένιο, σχηματίζοντας έναν δεσμό C-H μεταξύ του ɑ-άνθρακα και του πρωτονίου. Στη συνέχεια, η συζευγμένη βάση αποπρωτονιώνει το υδροξείδιο. Ένα μεμονωμένο ζεύγος από το ανιόν οξειδίου σχηματίζει στη συνέχεια έναν δεσμό pi με το καρβοκατιόν, με αποτέλεσμα μια κετόνη.
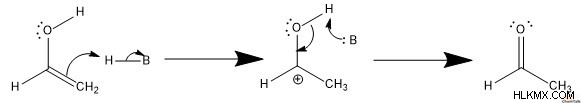
Αυτομερισμός υπό Βασικές Συνθήκες
Ο ταυτομερισμός κετο-ενόλης υπό βασικές συνθήκες ουσιαστικά έχει de - Πρωτονίωση που οδηγεί τη μετατροπή μεταξύ κετονών και ενολών.
Για να σχηματιστεί μια ενόλη, μια γενική βάση Brønsted-Lowry αποπρωτονιώνει τον α-άνθρακα. Αυτό οδηγεί τα ηλεκτρόνια pi του καρβονυλίου να σχηματίσουν έναν δεσμό αλκενίου pi με τον αποπρωτονιωμένο άνθρακα. Στη συνέχεια, το συζυγές οξύ πρωτονιώνει το ανιόν οξειδίου, σχηματίζοντας μια ενόλη.
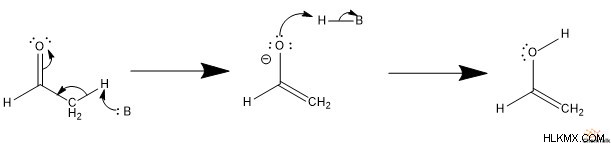
Για να σχηματιστεί μια κετόνη, η βάση αποπρωτονιώνει το υδροξείδιο, ελευθερώνοντας ένα μοναχικό ζεύγος ηλεκτρονίων. Αυτά τα ηλεκτρόνια στη συνέχεια σχηματίζουν ένα καρβονύλιο, ωθώντας ένα μοναχικό ζεύγος ηλεκτρονίων στον άνθρακα ɑ. Στη συνέχεια, το συζυγές οξύ πρωτονιώνει τον ɑ-άνθρακα, σχηματίζοντας μια κετόνη





