Λειτουργική ομάδα Αιθέρα
Βασικές έννοιες
Αυτό το σεμινάριο αφορά τη λειτουργική ομάδα αιθέρα. Θα καλύψει τη δομή της ομάδας αιθέρα και τις αντιδράσεις στις οποίες συμμετέχουν.
Θέματα που καλύπτονται σε άλλα άρθρα
- Λειτουργικές ομάδες
- Λειτουργική ομάδα εστέρα
- Λειτουργική ομάδα Amino
Τι είναι η Λειτουργική Ομάδα Ether;
Η αιθερική ομάδα αποτελείται από ένα άτομο οξυγόνου με μια ομάδα R μονοδεσμευμένη σε κάθε πλευρά. Αυτές οι ομάδες R μπορεί να είναι ίδιες, ωστόσο, δεν είναι πάντα.

Σε έναν αιθέρα, το οξυγόνο πρέπει να είναι συνδεδεμένο με άνθρακα και στις δύο πλευρές. Εάν μία από τις ομάδες R είναι άτομο υδρογόνου, τότε η ένωση είναι αλκοόλη.
Γρήγορα στοιχεία για την ομάδα Ether
- Δομή:Οξυγόνο που συνδέεται με δύο ομάδες αλκυλίου.
- Τύπος:R-O-R'
- Ατομικό βάρος:≥46,07 g/mol
- pH:Γενικά βασικό. Οι αιθέρες μπορούν να λειτουργήσουν ως Βάσεις Lewis λόγω των μοναχικών ζευγών στο Oxygen
- pKa:Όταν πρωτονιώνονται, οι αιθέρες έχουν pKa περίπου -3
- Ο διαιθυλαιθέρας είναι ένας κοινός διαλύτης
Συμβάσεις ονομασίας
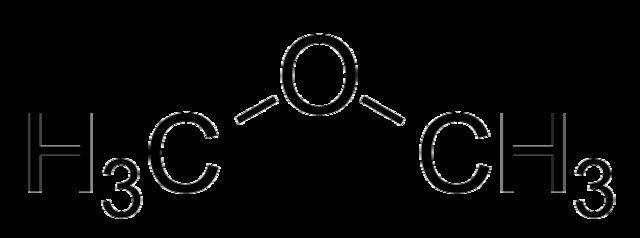
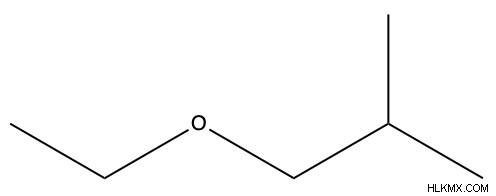
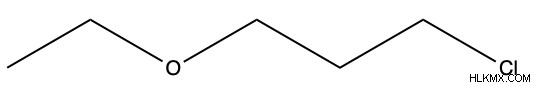
Η ονομασία των αιθέρων είναι αρκετά απλή. Οι δύο ομάδες R ονομάζονται αλφαβητικά και ακολουθεί το επίθημα "-ether". Εάν και οι δύο ομάδες R είναι ίδιες, το πρόθεμα "di-" πηγαίνει πριν από το όνομα της ομάδας R. Παρακάτω είναι μερικά παραδείγματα αιθέρων με τα ονόματά τους.
Αντιδράσεις ομάδας αιθέρα
Οι αιθέρες συμμετέχουν σε πολλές αντιδράσεις, πιο συχνά ως διαλύτες παρά ως αντιδρώντα. Οι αιθέρες τείνουν να μην αντιδρούν λόγω της δυσκολίας να σπάσουν οι απλοί δεσμοί C-O. Η πιο διάσημη αντίδραση που περιλαμβάνει αιθέρες είναι η Williamson Ether Synthesis, στην οποία ένα αλκοξείδιο αντιδρά με ένα αλκυλαλογονίδιο για να σχηματίσει έναν αιθέρα.
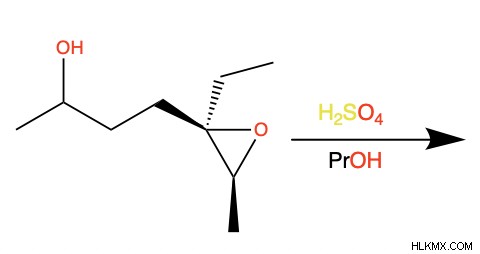
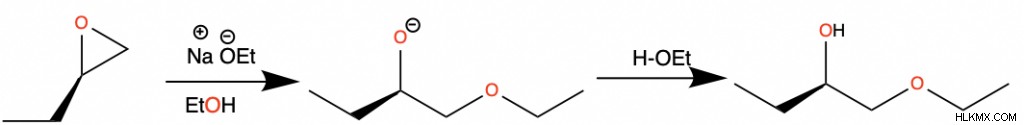
Εκτός από τη σύνθεσή τους, οι αιθέρες αντιδρούν μόνο υπό συγκεκριμένες συνθήκες. Για παράδειγμα, τα εποξείδια είναι ένας τύπος αιθέρα στον οποίο το οξυγόνο και τα άτομα άνθρακα που συνδέονται άμεσα με αυτό σχηματίζουν έναν τριμελή δακτύλιο. Επειδή οι γωνίες σύνδεσης είναι μικρές, ο δακτύλιος καταπονείται και μπορεί να σπάσει είτε σε όξινες είτε σε βασικές συνθήκες.
Williamson Ether Synthesis
Όταν ένα πρωτοταγές ή δευτεροταγές αλκυλαλογονίδιο αντιδρά με ένα αλκοξείδιο, το προϊόν της αντίδρασης είναι ένας αιθέρας. Η μία πλευρά του αιθέρα είναι μια αλυσίδα αλκυλίου από το αλκυλαλογονίδιο και η άλλη πλευρά είναι μια αλκυλική αλυσίδα που προέρχεται από το αλκοξείδιο. Ένα αλκοξείδιο είναι οποιαδήποτε ομάδα RO.
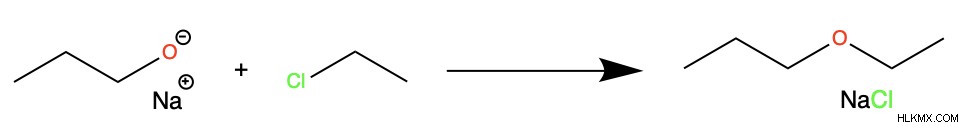
Το αλκυλαλογονίδιο πρέπει να είναι πρωτογενές ή δευτερογενές επειδή η σύνθεση προχωρά ως SN 2 αντίδραση. Για να εκτελέσει το πυρηνόφιλο αλκοξείδιο την επίθεση από την πίσω πλευρά στο αλκυλαλογονίδιο, πρέπει να υπάρχει αρκετός χώρος. Αυτό σημαίνει ότι τα τριτοταγή αλκυλαλογονίδια δεν μπορούν να υποστούν συνθέσεις αιθέρα Williamson.
Σχηματισμός και άνοιγμα εποξειδίου
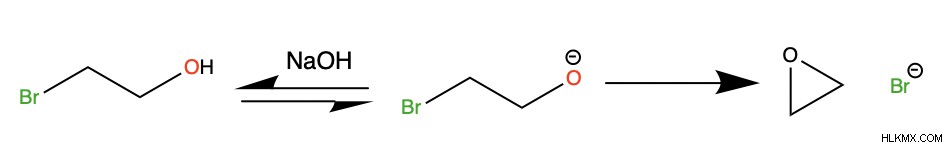
Τα εποξείδια είναι ένας τύπος αιθέρα. Είναι ετεροκυκλικές ενώσεις που περιέχουν ένα οξυγόνο και δύο άτομα άνθρακα. Ένας τρόπος σχηματισμού εποξειδίων είναι με την προσθήκη μιας βάσης και θερμότητας σε μια αλοϋδρίνη. Μια αλοϋδρίνη είναι μια ένωση που περιέχει και μια ομάδα ΟΗ και ένα αλογονίδιο.
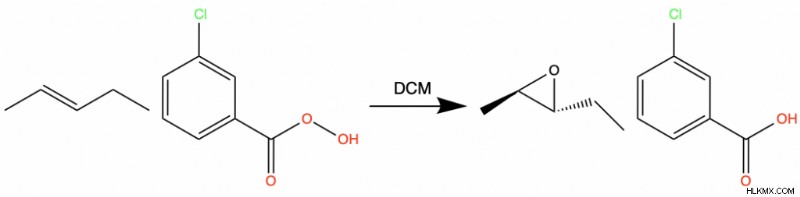
Εποξείδια σχηματίζονται επίσης όταν ένα αλκένιο αντιδρά με μετα-χλωροϋπερβενζοϊκό οξύ ή m-CPBA.
Οι δακτύλιοι εποξειδίου μπορούν να ανοίξουν τόσο σε όξινες όσο και σε βασικές συνθήκες. Σε όξινες συνθήκες, το πυρηνόφιλο επιτίθεται στον δακτύλιο στην πιο υποκατεστημένη πλευρά. Η στερεοχημεία αντιστρέφεται στον ηλεκτροφιλικό άνθρακα.
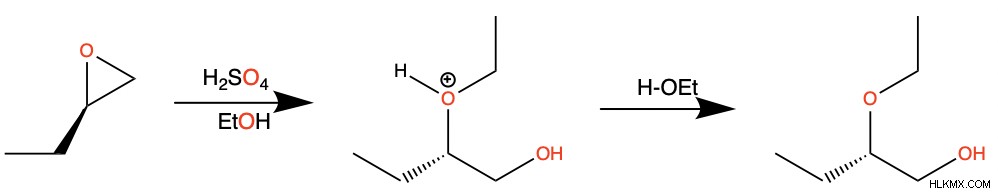
Σε βασικές συνθήκες, το πυρηνόφιλο επιτίθεται στον δακτύλιο στην λιγότερο υποκατεστημένη πλευρά.
Οι αιθέρες ως διαλύτες
Οι αιθέρες χρησιμεύουν ως διαλύτες σε μια ποικιλία οργανικών αντιδράσεων. Είναι μέτρια πολικά και απρωτικά. Αυτό σημαίνει ότι οι αιθέρες μπορούν να δεχτούν μόνο δεσμούς υδρογόνου.
Διαιθυλαιθέρας
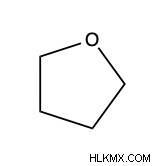
Ένα από τα πιο γνωστά παραδείγματα αυτής της λειτουργικής ομάδας είναι ο διαιθυλαιθέρας. Ο διαιθυλαιθέρας είναι ένας χρήσιμος διαλύτης για μια ποικιλία αντιδράσεων. Ιστορικά, χρησιμοποιήθηκε ως αναισθητικό. Ωστόσο, λόγω της ευφλεκτότητάς του, εναλλακτικές λύσεις αντί του διαιθυλαιθέρα είναι πιο κοινές. Στη σύγχρονη βιομηχανία, το τετραϋδροφουράνιο κυκλικού αιθέρα είναι πιο κοινό από τον διαιθυλαιθέρα λόγω της ευφλεκτότητας του τελευταίου.
Ο διαιθυλαιθέρας είναι εξαιρετικά πτητικός. Παρόλο που έχει σημείο βρασμού 34,6°C, ο διαιθυλαιθέρας θα εξατμιστεί γρήγορα όταν αφεθεί σε ανοιχτό δοχείο.
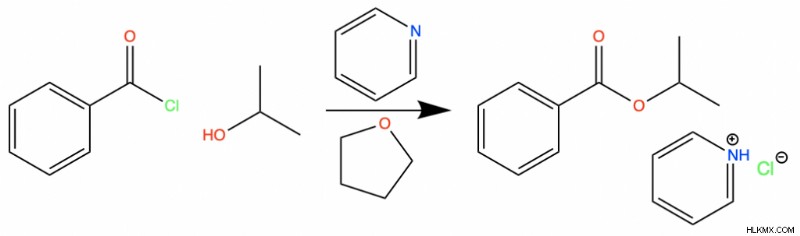
Οι αιθερικοί διαλύτες εμπλέκονται συχνά στην εστεροποίηση των χλωριδίων του οξέος. Αυτός ο τύπος αντίδρασης είναι η αντικατάσταση ενός ατόμου χλωρίου δίπλα σε μια ομάδα καρβονυλίου με μια αλκοξυ ομάδα. Μια αλκοξυ ομάδα είναι οποιαδήποτε ομάδα RO όπου το οξυγόνο συνδέει την ομάδα R με την υπόλοιπη ένωση.
Ερωτήσεις εξάσκησης
- Σχεδιάστε τις Δομές των παρακάτω τεσσάρων αιθέρων:
- διισοπροπυλαιθέρας
- κυκλοβουτυλομεθυλαιθέρας
- Διφαινυλαιθέρας
- Δικυκλοπεντυλαιθέρας
Προβλέψτε το γινόμενο της ακόλουθης αντίδρασης: