SO3 Μοριακή Γεωμετρία και Γωνίες Δεσμών
Η χημική ουσία τριοξείδιο του θείου (γνωστή και ως nisso sulfan) έχει τον τύπο SO3 (εναλλακτική ορθογραφία:θείο τριοξείδιο). «Αναμφισβήτητα το πιο σημαντικό εμπορικά», σύμφωνα με το Sulphur Oxide. Παράγεται σε τεράστιες ποσότητες ως πρόδρομος του θειικού οξέος. Το τριοξείδιο του θείου έρχεται σε διάφορες μορφές, συμπεριλαμβανομένων των αέριων μονομερών, των κρυσταλλικών τριμερών και των στερεών πολυμερών. Το τριοξείδιο του θείου είναι στερεό με στενή περιοχή υγρών σε ελαφρώς χαμηλότερη θερμοκρασία περιβάλλοντος. Η όξινη βροχή προκαλείται κυρίως από το αέριο SO3. Μια δομή Lewis είναι μια απεικόνιση των ηλεκτρονίων του κελύφους σθένους ενός μορίου. Χρησιμοποιείται για να απεικονίσει πώς κατανέμονται τα ηλεκτρόνια σε ένα μόριο. Το πιο ενδιαφέρον θέμα είναι η μοριακή γεωμετρία του τριοξειδίου του θείου.
Μοριακή γεωμετρία του τριοξειδίου του θείου
Η τρισδιάστατη δομή των ατόμων που βοηθά στο σχηματισμό ενός μορίου είναι γνωστή ως μοριακή γεωμετρία. Μπορεί να σας ενημερώσει για την αντιδραστικότητα, την πολικότητα, το χρώμα, την έλξη και τη βιολογική δραστηριότητα, μεταξύ άλλων.
Στο Trioxide του θείου, ένα άτομο θείου και τρία άτομα οξυγόνου τεντώνονται όσο το δυνατόν περισσότερο! Τα ηλεκτρόνια περικυκλώνουν τα άτομα οξυγόνου. Τα αρνητικά ηλεκτρόνια απωθούν τα αρνητικά ηλεκτρόνια.
Το AXN είναι ένας άλλος τρόπος να θυμάστε τη μοριακή γεωμετρία του SO3.
- Το θείο, το κεντρικό άτομο, αντιπροσωπεύεται από το γράμμα A.
- Το γράμμα X υποδηλώνει τον αριθμό των ατόμων που συνδέονται με το κεντρικό θείο.
- Τυχόν μη δεσμευτικά ζεύγη ηλεκτρονίων συμβολίζονται με το γράμμα N.
- Επειδή δεν υπάρχουν μη συνδεδεμένα ηλεκτρόνια σε αυτόν τον τύπο SO3, δεν χρειάζεται να ανησυχούμε για το Ν. Επιπλέον, επειδή υπάρχουν τρία άτομα οξυγόνου, το αποτέλεσμα θα είναι X3.
Σαν αποτέλεσμα, το μόριο SO3 έχει AX3. (Παρεμπιπτόντως, αυτός είναι ο λόγος που το SO3 έχει μια Τριγωνική Επίπεδη μορφή.) Το SO3 έχει γωνία δεσμού 120 μοιρών.
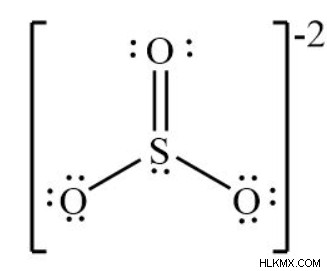
Μοριακή γεωμετρία SO3 – δομή Lewis
- Μετρήστε πόσα Ηλεκτρόνια σθένους συνεισφέρει κάθε άτομο στην εξίσωση. Το SO3 έχει συνολικά 24 ηλεκτρόνια. Το SO3 2- έχει συνολικά 26 ηλεκτρόνια.
- Τοποθετήστε το άτομο με το λιγότερο ηλεκτραρνητικό φορτίο στη μέση. Το θείο υπάρχει και στις δύο περιπτώσεις.
- Υπάρχουν τρία από αυτά όταν βάζετε τα πιο ηλεκτραρνητικά άτομα που περιβάλλουν το άτομο Θείου.
- Σχεδιάστε έξι ηλεκτρόνια σθένους σε ζεύγη των δύο γύρω από κάθε άτομο (καθώς όλα έχουν έξι).
- Υπάρχουν συνολικά 12 ηλεκτρόνια μεταξύ του ενός ατόμου θείου και των τριών ατόμων οξυγόνου.
- Δημιουργήστε διπλούς δεσμούς. Ένας απλός δεσμός απαιτεί δύο ηλεκτρόνια για να σχηματιστεί. Ένας διπλός δεσμός απαιτεί τέσσερα ηλεκτρόνια για να σχηματιστεί.
- Δεν υπάρχει φόρος στο τριοξείδιο του θείου. Επειδή το θείο είναι αδύναμο σε σύγκριση με το οξυγόνο, παραδίδει τα ηλεκτρόνια του στα άτομα οξυγόνου επειδή είναι τόσο ηλεκτραρνητικά.
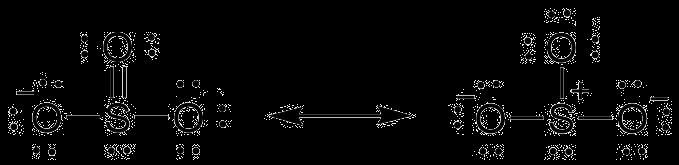
Μοριακή γεωμετρία SO3 – Τι προκαλεί το SO3 να δημιουργεί διπλούς δεσμούς;
Το χημικό τριοξείδιο του θείου έχει τριγωνική επίπεδη δομή. Το θείο καταλαμβάνει το κέντρο του μορίου επειδή είναι λιγότερο ηλεκτραρνητικό από το οξυγόνο. Διαθέτει έξι ηλεκτρόνια και τα μοιράζεται όλα με τα τρία άτομα οξυγόνου, σχηματίζοντας διπλούς δεσμούς.
Πώς το Sulfur παραβιάζει τον κανόνα της οκτάδας;
Στη μοριακή γεωμετρία SO3, το θείο έχει αριθμό ηλεκτρονίων σθένους έξι. Στο τροχιακό 3s, υπάρχει το 2, ενώ στο τροχιακό 3p, το 4. Για να δημιουργηθούν 8 ηλεκτρόνια σθένους, απαιτούνται απλώς 2 επιπλέον ηλεκτρόνια στο τροχιακό 3p. Κανονικά, αυτό θα σήμαινε ότι η αναμενόμενη φόρμουλα για το φθόριο του θείου είναι SF2, όχι SF4. Από την άλλη πλευρά, τα ηλεκτρόνια του 3ου ενεργειακού επιπέδου του θείου έχουν πρόσβαση στο 3d υποεπίπεδο. Αυτό σημαίνει ότι περισσότερα από 8 ηλεκτρόνια μπορούν να υποστηριχθούν ως ηλεκτρόνια σθένους.
Το τροχιακό που προκύπτει ονομάζεται "dsp3 hybrided" καθώς είναι υβρίδιο. Γύρω από το θείο, υπάρχει ένα μοναχικό ζεύγος και τέσσερα δεσμευτικά ζεύγη ηλεκτρονίων σθένους. Το υποεπίπεδο d δεν είναι προσβάσιμο σε στοιχεία στις δύο πρώτες περιόδους του περιοδικού πίνακα. Ως αποτέλεσμα, ακολουθούν τον κανόνα της οκτάδας.
Ο υβριδισμός του SO3
Το SO3 έχει υβριδισμό sp2. Υπολογίζεται χρησιμοποιώντας τον ακόλουθο τύπο:
Αριθμός δεσμών σίγμα + Αριθμός μεμονωμένων ζευγών =Αριθμός υβριδικών τροχιακών
Ένας δεσμός σίγμα και ένας δεσμός pi υπάρχουν σε έναν κοινό κοινό διπλό ομοιοπολικό δεσμό.
Έτσι, σε ένα μόριο SO3, υπάρχουν τρεις δεσμοί σίγμα και μηδενικά ζεύγη μεμονωμένων μερών (επιβεβαιώνεται με το δομή Lewis).
Σαν αποτέλεσμα, ο αριθμός των υβριδικών τροχιακών είναι 3 + 0 =3. Ένα τροχιακό και δύο p τροχιακά του ίδιου κελύφους μέσα σε ένα άτομο επικαλύπτονται και αναμειγνύονται για να σχηματίσουν τρία νέα υβριδικά τροχιακά συγκρίσιμης ενέργειας στον υβριδισμό sp2.
Συμπέρασμα
Η περίοδος 3 του περιοδικού πίνακα χαρακτηρίζεται από στοιχεία που τείνουν να επεκτείνουν την οκτάδα τους και να φιλοξενούν περισσότερα από οκτώ ηλεκτρόνια σθένους. Αξίζει να σημειωθεί ότι αυτή η συμπεριφορά δεν είναι ασυνήθιστη, καθώς τα περισσότερα στοιχεία, με εξαίρεση τα στοιχεία της περιόδου δύο, την εμφανίζουν. Επειδή ένας δεσμός σίγμα και ένας δεσμός pi σχηματίζονται στο SO3, ο υβριδισμός είναι sp2. Αυτές ήταν όλες οι πληροφορίες σχετικά με τη μοριακή δομή SO3 και τη μοριακή δομή SO3 και τα παραδείγματα γωνίας δεσμού. Ως εκ τούτου, είναι σαφές ότι το SO3 είναι ένα μη πολικό μόριο που σχηματίζει δεσμό 120 μοιρών.




