Παρούσα μορφή του περιοδικού πίνακα
Η δημοτικότητα του σύγχρονου περιοδικού πίνακα οφείλεται στο ότι είναι μια εύχρηστη αναφορά. Αυτός ο πίνακας έχει απλοποιήσει τη μελέτη της χημείας. Απομνημονεύοντας τον περιοδικό πίνακα των στοιχείων, μπορείτε να εντοπίσετε τις φυσικές και χημικές τους ιδιότητες. Οι προβλέψεις σχετικά με τις ενώσεις που σχηματίζονται από ένα στοιχείο καθορίζονται με βάση τη θέση του στον πίνακα.
Παρούσα φόρμα του περιοδικού πίνακα
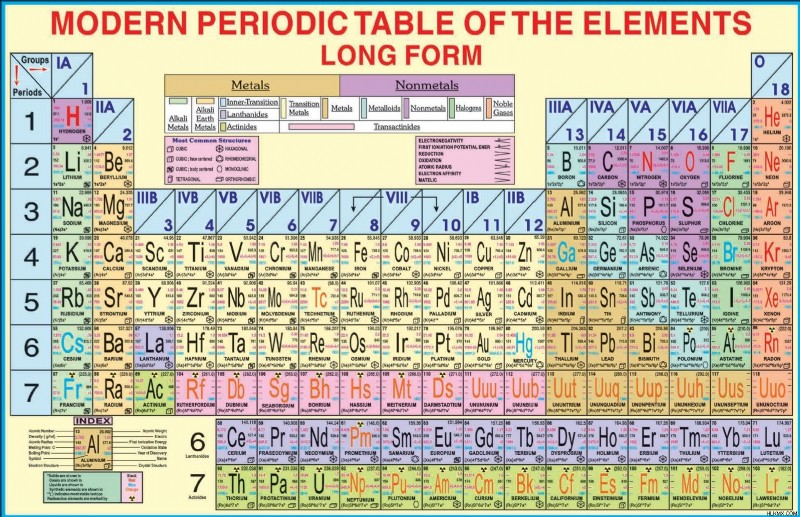
Ένας περιοδικός πίνακας στοιχείων χρησιμοποιεί μια μορφή πίνακα για να αναπαραστήσει τα χημικά στοιχεία που ανακαλύφθηκαν. Σε αυτόν τον πίνακα, τα στοιχεία τοποθετούνται κάτω από γραμμές (περιόδους) και στήλες (ομάδες) με την αύξουσα σειρά των ατομικών τους αριθμών.
Ο Ρώσος χημικός και εφευρέτης Dmitri Mendeleev δημοσίευσε την πρώτη έκδοση του σύγχρονου περιοδικού πίνακα το 1869. Ο περιοδικός πίνακας έχει εξελιχθεί για να αντικατοπτρίζει δεκαετίες επιστημονικής εξέλιξης στη χημεία και τη φυσική. Μέχρι σήμερα, το πιο σημαντικό επίτευγμα στην επιστήμη είναι ο σύγχρονος περιοδικός πίνακας. Αυτός ο πίνακας αποτελείται από 18 κάθετες στήλες, επτά οριζόντιες σειρές και 118 στοιχεία.
Ποιες είναι οι περιοδικές τάσεις του σύγχρονου περιοδικού πίνακα;
Συγκεκριμένα μοτίβα στον περιοδικό πίνακα που απεικονίζουν διαφορετικές πτυχές ενός στοιχείου είναι το εύρος των περιοδικών τάσεων. Περιλαμβάνει το μέγεθος και τις ηλεκτρονικές ιδιότητες του στοιχείου. Αυτές οι τάσεις προκύπτουν από παρόμοιες ατομικές δομές μεταξύ των στοιχείων και την περιοδική φύση τους.
Ας παρουσιάσουμε τώρα τις περιοδικές τάσεις του περιοδικού πίνακα:
· Τάσεις ηλεκτροαρνητικότητας:
Μια χημική ιδιότητα ενός ατόμου που περιγράφει την ικανότητά του να έλκει και να δεσμεύεται με ηλεκτρόνια ορίζεται ως ηλεκτραρνητικότητα. Ωστόσο, δεν υπάρχει τυπική μέθοδος για τον υπολογισμό της ηλεκτραρνητικότητας λόγω των ποιοτικών ιδιοτήτων της.
Η τάση ενός ατόμου ενός δεδομένου χημικού στοιχείου να προσελκύει κοινά ηλεκτρόνια στη διαδικασία σχηματισμού ενός χημικού δεσμού, είναι αυτό που ορίζει την ηλεκτραρνητικότητα. Ο Linus Pauling εισήγαγε την έννοια της ηλεκτραρνητικότητας το 1932. Η κλίμακα Pauling εξηγεί τη σχέση μεταξύ της ενέργειας ενός δεσμού και της ηλεκτραρνητικότητας.
Σε μια περίοδο από αριστερά προς τα δεξιά, η ηλεκτραρνητικότητα αυξάνεται. Ωστόσο, αντίθετα με αυτό, το ίδιο μειώνεται καθώς μετακινείστε προς τα κάτω σε μια ομάδα. Το πρώτο συμβαίνει επειδή το πυρηνικό φορτίο αυξάνεται γρήγορα σε σύγκριση με τη θωράκιση των ηλεκτρονίων όταν μετακινείται από αριστερά προς τα δεξιά.
· Τάσεις συγγένειας ηλεκτρονίων:
Η ικανότητα ενός ατόμου να δέχεται ένα ηλεκτρόνιο από ένα ουδέτερο άτομο σε αέρια φάση είναι αυτό που μπορεί να οριστεί ως συγγένεια ηλεκτρονίων.
Η συγγένεια ηλεκτρονίων ενός ατόμου ή μορίου έχει να κάνει με την ποσότητα ενέργειας που απελευθερώνεται κάθε φορά που ένα ηλεκτρόνιο συνδέεται με ένα ουδέτερο άτομο ή μόριο σε αέρια κατάσταση που οδηγεί στο σχηματισμό ενός ανιόντος.
Όσο πιο αρνητική είναι η τιμή συγγένειας ηλεκτρονίων, τόσο μεγαλύτερη είναι η συγγένεια ενός ατόμου για τα ηλεκτρόνια. Η συγγένεια ηλεκτρονίων μπορεί να μετρηθεί ποσοτικά για να επισημάνει την αλλαγή ενέργειας που συμβαίνει όταν ένα ηλεκτρόνιο προστίθεται σε ένα ουδέτερο άτομο αερίου.
Πρέπει να γνωρίζετε ότι η συγγένεια ηλεκτρονίων θα αυξάνεται από αριστερά προς τα δεξιά σε έναν περιοδικό πίνακα.
Η μείωση της ατομικής ακτίνας προκαλεί αυτό. Ομοίως, η συγγένεια ηλεκτρονίων μειώνεται από πάνω προς τα κάτω μέσα σε μια ομάδα. Και πάλι, αυτό είναι αποτέλεσμα της αύξησης της ατομικής ακτίνας.
· Τάσεις ενέργειας ιονισμού:
Οι τάσεις της ενέργειας ιονισμού σχετίζονται με την ενέργεια που απαιτείται για την αφαίρεση ενός ηλεκτρονίου από ένα απομονωμένο άτομο ή μόρια. Καθώς μετακινείστε προς τα κάτω στην ομάδα, η ενέργεια ιονισμού μειώνεται. Αυτό συμβαίνει λόγω της θωράκισης ηλεκτρονίων. Ωστόσο, η ενέργεια ιονισμού αυξάνεται όταν μετακινείστε αριστερά προς τα δεξιά σε έναν περιοδικό πίνακα. Αυτό είναι αποτέλεσμα της σταθερότητας του κελύφους σθένους.
Τα ευγενή αέρια διαθέτουν πλήρη κελύφη σθένους. Άμεσο αποτέλεσμα αυτού είναι να διατηρούν υψηλές ενέργειες ιονισμού. Λαμβάνοντας υπόψη όλα τα στοιχεία του περιοδικού πίνακα, αυτό με την υψηλότερη ενέργεια ιονισμού είναι το ήλιο.
· Τάσεις ατομικής ακτίνας:
Η ατομική ακτίνα είναι η μισή απόσταση μεταξύ των πυρήνων δύο ατόμων. Ωστόσο, η πολυπλοκότητα μπαίνει στο παιχνίδι επειδή δεν είναι όλα τα άτομα συνδεδεμένα μεταξύ τους με τον ίδιο τρόπο.
Η ατομική ακτίνα μειώνεται από αριστερά προς τα δεξιά στην περίοδο. Αυτό οφείλεται στην αύξηση του αριθμού των πρωτονίων και των ηλεκτρονίων σε μια περίοδο. Τα πρωτόνια έχουν μεγαλύτερη επίδραση από τα ηλεκτρόνια. Το αποτέλεσμα είναι τα ηλεκτρόνια να έλκονται προς τον πυρήνα, με αποτέλεσμα μια μικρότερη ακτίνα.
Από την άλλη πλευρά, η ατομική ακτίνα αυξάνεται από πάνω προς τα κάτω σε μια ομάδα.
·Τάσεις σημείου τήξης:
Το Σημείο Τήξης ενός στοιχείου θα μπορούσε να εξηγηθεί ως η ενέργεια που απαιτείται για να αλλάξει η κατάσταση του στοιχείου από στερεό σε υγρό. Επομένως, όσο ισχυρότερος είναι ο δεσμός μεταξύ των ατόμων, τόσο υψηλότερο θα είναι το σημείο τήξης.
Δεδομένου ότι τα σημεία τήξης ποικίλλουν, δεν σχηματίζουν διακριτή τάση στον περιοδικό πίνακα. Ωστόσο, μπορεί να παρατηρηθεί ένα περίεργο μοτίβο.
Στην περίπτωση των μετάλλων, προβάλλεται υψηλό σημείο τήξης. Τα μη μέταλλα έχουν χαμηλότερα σημεία τήξης. Γνωρίζουμε ότι υπάρχει μια εξαίρεση σε κάθε περίπτωση.
Ο άνθρακας, ένα μη μέταλλο, έχει το υψηλότερο σημείο τήξης από όλα τα στοιχεία. Επιπλέον, το ημιμεταλλικό βόριο έχει υψηλό σημείο τήξης.
· Μεταλλικές τάσεις χαρακτήρων:
Ο μεταλλικός χαρακτήρας ενός στοιχείου έχει να κάνει με την ετοιμότητα ενός ατόμου να χάσει ένα ηλεκτρόνιο. Από αριστερά προς τα δεξιά σε μια περίοδο, τα μεταλλικά χαρακτηριστικά μειώνονται. Αυτό οφείλεται στη μείωση της ακτίνας του ατόμου, η οποία επιτρέπει στα εξωτερικά ηλεκτρόνια να ιονίζονται πιο εύκολα.
Ομοίως, τα μεταλλικά χαρακτηριστικά αυξάνουν την ομάδα. Η ατομική ακτίνα αυξάνεται λόγω της ηλεκτρονικής θωράκισης. Ο μεταλλικός χαρακτήρας έχει να κάνει με την ικανότητα απώλειας ηλεκτρονίων. Σε αντίθεση με αυτό, ο μη μεταλλικός χαρακτήρας σχετίζεται με την ικανότητα απόκτησης ηλεκτρονίων.
Συμπέρασμα:
Η δημοτικότητα του σύγχρονου περιοδικού πίνακα οφείλεται στο ότι είναι μια εύχρηστη αναφορά. Αυτός ο πίνακας έχει απλοποιήσει τη μελέτη της χημείας. Απομνημονεύοντας τον περιοδικό πίνακα των στοιχείων, μπορείτε να εντοπίσετε τις φυσικές και χημικές τους ιδιότητες. Οι προβλέψεις σχετικά με τις ενώσεις που σχηματίζονται από ένα στοιχείο καθορίζονται με βάση τη θέση του στον πίνακα.
Αυτός ο πίνακας λειτουργεί ως πλούσια πηγή πληροφοριών. Επιπλέον, επισημαίνει λεπτομέρειες σχετικά με τη σχέση μεταξύ διαφορετικών στοιχείων.




