Θεωρίες οξέων βάσεων:Arrhenius &Bronsted-Lowry Acids
Βασικές έννοιες
Σε αυτό το σεμινάριο, θα συγκρίνετε και θα αντιπαραβάλλετε διαφορετικές θεωρίεςόξινης βάσης. Θα μυηθείτε στις θεωρίες Arrhenius και Bronsted-Lowry , και την ιδέα ενός οξέος Arrhenius και ενός οξέος Bronsted-Lowry (Bronsted acid).
Βεβαιωθείτε ότι έχετε διαβάσει το σεμινάριο Lewis Acids &Bases για να μάθετε για τη θεωρία Lewis!
Θέματα που καλύπτονται σε άλλα άρθρα
- Χημεία οξέος-βάσης
- Ορισμός του pH
- Ισχυρά οξέα και βάσεις
- Ιδιότητες οξέων και βάσεων
- Καθαρές ιοντικές εξισώσεις
- Κοινό φαινόμενο ιόντων
- Αντίδραση εξουδετέρωσης οξέων βάσεων
- Ksp – Σταθερά προϊόντος διαλυτότητας
Τι είναι οι θεωρίες οξέων βάσεων;
Υπάρχουν 3 διαφορετικές θεωρίες όξινης βάσης στη χημεία. καθεμία από αυτές τις θεωρίες έχει τον δικό της ορισμό για το τι χαρακτηρίζεται ως αντίδραση οξέος-βάσης. Ας μάθουμε τα διαφορετικά προσόντα κάθε θεωρίας παρακάτω!
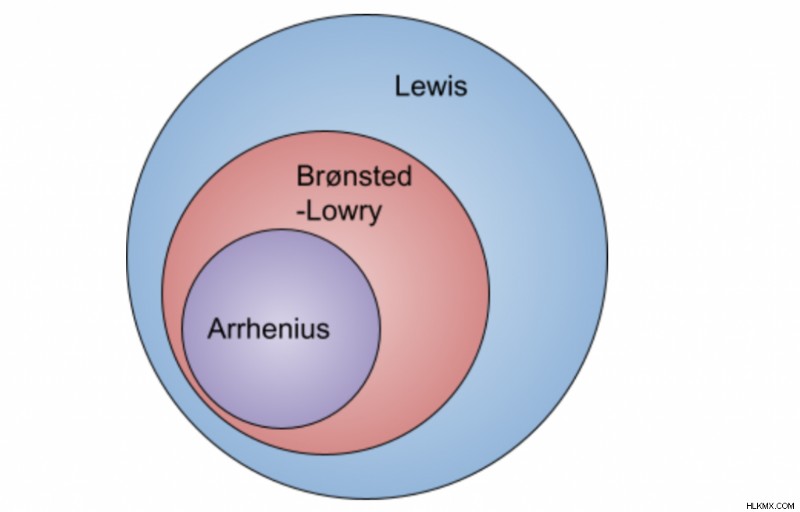
Οξέα και βάσεις Arrhenius
Αυτή η θεωρία ορίζει τόσο το οξύ όσο και τη βάση ως μια ένωση που μπορεί να διασπαστεί στο νερό, που σημαίνει ότι διασπάται στα αντίστοιχα ιόντα (δηλαδή HBr → H + Br).
Ένα οξύ Arrhenius είναι μια ένωση που δίνει ιόντα Η+ σε διάλυμα. Νιτρικό οξύ, HNO3 , είναι ένα παράδειγμα οξέος Arrhenius γιατί θα διασπαστεί και θα δημιουργήσει H και ΟΧΙ3 ιόντων. Τα ιόντα υδρογόνου στη συνέχεια ενώνονται με νερό για να σχηματίσουν H3 O; Αυτό συμβαίνει επειδή το μοναχικό ζεύγος του οξυγόνου έλκει το υδρογόνο, το οποίο είναι πολύ αδύναμο για να υπάρχει μόνο του σε διάλυμα.
H-A(aq) → H(aq) + A(aq)
H-A (aq) + H2 O (l ) → H3 O(aq) + A(aq)
Από την άλλη πλευρά, μια βάση Arrhenius είναι μια ένωση που αποδίδει ιόντα ΟΗ σε διάλυμα. Το υδροξείδιο του καλίου, ΚΟΗ, είναι μια βάση Arrhenius επειδή θα διασπαστεί και θα δημιουργήσει K και OH ιόντα.
B-OH (aq) → B(aq) + OH(aq)
Επιπλέον, λαμβάνει χώρα εξουδετέρωση εντός του διαλύματος λόγω των ιόντων Η και ΟΗ που επίσης αντιδρούν μαζί για να σχηματίσουν νερό.
H(aq) + OH(aq) → H2 O(l )
Η θεωρία Arrhenius έχει την μεγαλύτερη εξειδίκευση από τις τρεις θεωρίες, επειδή δηλώνει ότι είτε το ιόν Η είτε το ΟΗ πρέπει να υπάρχει για να επισημανθεί ως οξύ ή βάση. Ωστόσο, αυτό δεν ισχύει σε άλλες θεωρίες. Ας προχωρήσουμε σε μια πιο γενική θεωρία που περιλαμβάνει περισσότερες ενώσεις – την έννοια του οξέος Bronsted-Lowry.
Οξέα και βάσεις Bronsted-Lowry
Αυτός ο ορισμός οξέων και βάσεων μπορεί να χρησιμοποιηθεί για την ανάλυση διαλυμάτων που περιέχουν και δεν περιέχουν νερό. έχει να κάνει με το πόσο καλά μια ένωση μπορεί να δεχθεί ή να δώσει πρωτόνια.
Ένα οξύ Bronsted-Lowry, γνωστό και ως Bronsted Acid, είναι δότης πρωτονίων, που σημαίνει ότι μπορεί να απελευθερώσει ένα πρωτόνιο. όταν ένα οξύ διασπάται στο διάλυμα, αυξάνει την απόδοση Η+. Και πάλι, νιτρικό οξύ, HNO3 , μπορεί να επισημανθεί ως οξύ επειδή θα διασπαστεί και θα δημιουργήσει H+ και ΟΧΙ3 ιόντα.
H-A(aq) → H(aq) + A(aq)
H-A(aq) + H2 O(l ) → H3 O(aq) + A(aq)
Μια βάση Bronsted-Lowry, γνωστή και ως βάση Bronsted, είναι ένας δέκτης πρωτονίων. όταν μια βάση διασπάται, χρειάζεται ένα πρωτόνιο από το νερό για να δημιουργήσει ιόντα ΟΗ σε διάλυμα. Το ίδιο και το NH3 οξύ ή βάση; Αμμωνία, NH3 , είναι ένα παράδειγμα βάσης επειδή παίρνει ένα πρωτόνιο από το νερό για να σχηματίσει τα προϊόντα του NH4 και OH.
B(aq) + H2 O(l ) → B-H(aq) + OH(aq)
Σε αυτή τη θεωρία, το νερό μπορεί να είναι είτε οξύ είτε βάση. Αυτό συμβαίνει γιατί μπορεί να δεχθεί ένα πρωτόνιο να σχηματίσει H3 O ή δωρίστε ένα πρωτόνιο για να σχηματίσετε ΟΗ. όταν μια ένωση μπορεί να δράσει και ως οξύ ή βάση Bronsted-Lowry, λέγεται ότι είναι αμφοτερική .
Η θεωρία Bronsted-Lowry προσθέτει στη θεωρία του Arrhenius. Η γενική ιδέα της απόδοσης ιόντων Η και ΟΗ είναι η ίδια, αλλά αυτή η θεωρία είναι πιο γενική, γεγονός που επιτρέπει σε περισσότερες ενώσεις να επισημαίνονται ως οξέα ή βάσεις. Για παράδειγμα, οι βάσεις δεν χρειάζεται να περιέχουν ΟΗ (πρέπει να περιέχουν στη θεωρία του Arrhenius) επειδή η λήψη ενός πρωτονίου από το νερό σχηματίζει το ιόν υδροξειδίου.
Θεωρία οξέων Lewis και βάσεων
Αυτή η θεωρία έχει τη μικρότερη εξειδίκευση, που σημαίνει ότι επιτρέπει μια ευρεία επιλογή οξέων και βάσεων. Ένα οξύ Lewis είναι ένας δέκτης ζεύγους ηλεκτρονίων, ενώ μια βάση Lewis είναι ένας δότης ζεύγους ηλεκτρονίων. Δεν γίνεται αναφορά σε πρωτόνια ή υδρογόνα, γεγονός που δημιουργεί την ευκαιρία για περισσότερες ενώσεις να ταιριάζουν σε αυτήν την κατηγορία. Η θεωρία Lewis δηλώνει ότι μια βάση Lewis δωρίζει ένα ζεύγος ηλεκτρονίων που είτε μοιράζονται είτε χρησιμοποιούνται από ένα οξύ Lewis. Διαβάστε το σεμινάριο Lewis Acids &Bases για περισσότερες λεπτομέρειες!
Περαιτέρω ανάγνωση
- Οι χημικές αντιδράσεις γίνονται εύκολα
- Αντιδράσεις οξειδοαναγωγής
- Υπολογισμός ποσοστού κατά βάρος




