Μηχανισμός Αντίδρασης Perkin
Μια αντίδραση Perkin παράγει ένα βήτα ακόρεστο αρωματικό οξύ («βήτα ακόρεστο» σημαίνει ότι έχει διπλό δεσμό) , μια ομάδα καρβοξυλικού οξέος με συμπύκνωση αλδόλης μιας ομάδας αρωματικής αλδεΰδης (που σημαίνει ότι έχει -CHO) και έναν ανυδρίτη οξέος παρουσία αλκαλικού άλατος του οξέος, το οποίο δρα ως καταλύτης βάσης για να επιταχύνει την αντίδραση. Στους 180°C, η αλδεΰδη θερμαίνεται με περίσσεια ανυδρίτη οξέος για να ολοκληρωθεί η αντίδραση. Υπό τις συνθήκες αντίδρασης, συνήθως συμβαίνει αφυδάτωση, με αποτέλεσμα έναν ανυδρίτη. Η περίσσεια αλδεΰδης απομακρύνεται με απόσταξη με ατμό και το προκύπτον ακόρεστο οξύ λαμβάνεται μέσω υδρόλυσης ανυδρίτη με αραιό HCl.
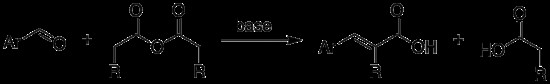
Μηχανισμός αντίδρασης περκιν
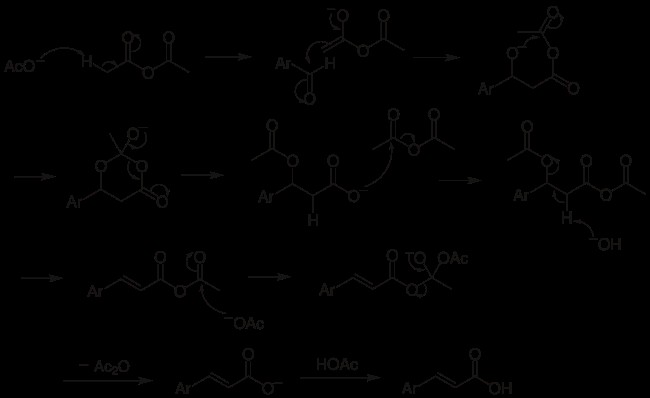
Τα παρακάτω βήματα αποτελούν τον ευρέως αποδεκτό μηχανισμό της αντίδρασης Perkin:
Το καρβοξυλικό ιόν αφαιρεί ένα πρωτόνιο για να δημιουργήσει το σταθεροποιημένο με συντονισμό καρβανιόν, το οποίο είναι ένα είδος που περιέχει άνθρακα με αρνητικό φορτίο.
Η πυρηνόφιλη σύνδεση του καρβανιόν στο καρβονυλικό άτομο άνθρακα της αλδεΰδης έχει ως αποτέλεσμα το σχηματισμό ενός τετραεδρικού ενδιάμεσου.
Το οξικό οξύ που δημιουργήθηκε κατά τη διαδικασία πρωτονοποίησε το τετραεδρικό ενδιάμεσο.
Η αφαίρεση ενός μορίου νερού από ένα παράγωγο υδροξυλίου.
Το ακόρεστο μόριο υδρολύεται, δηλαδή η προσθήκη νερού στο ακόρεστο οξύ.
Εφαρμογές
Χρησιμοποιείται στο εργαστήριο για τη σύνθεση κινναμωμικού οξέος. Η κανέλα και το βούτυρο καριτέ περιλαμβάνουν και τα δύο κινναμωμικά οξέα, τα οποία είναι φυσικά ακόρεστα αρωματικά καρβοξυλικά οξέα.
Μπορεί να χρησιμοποιήσουμε αυτήν την αντίδραση για να δημιουργήσουμε - και - ακόρεστα αρωματικά οξέα, τα οποία χρησιμοποιούνται συνήθως στη φαρμακευτική βιομηχανία.
Συμπύκνωση Perkin
Η αντίδραση Perkin συμβαίνει όταν οι αρωματικές αλδεΰδες αντιδρούν με αλκανοϊκούς ανυδρίτες παρουσία αλκανοϊκού. Αυτή η αντίδραση είναι ανάλογη με τη συμπύκνωση αλδόλης.
Το καρβανιόν σχηματίζεται στην αντίδραση με καρβοξυλικό απομακρύνοντας ένα άτομο υδρογόνου Άλφα από ανυδρίτη οξέος (ανιόν του αντίστοιχου οξέος του ανυδρίτη οξέος). Στη συνέχεια, το καρβανιόν αντιδρά με την αρωματική αλδεΰδη για να παράγει ανιόν αλκοξειδίου. Η ακετυλομάδα στη συνέχεια μεταφέρεται από το καρβοξυλικό οξυγόνο στο αλκοξυοξυγόνο μέσω ενός κυκλικού ενδιάμεσου για να παραχθεί ένα πιο σταθερό ανιόν. Η απώλεια μιας καλής αποχωρούσας ομάδας από τη θέση να δώσει ένα ανιόν του Άλφα, βήτα ακόρεστου οξέος προκύπτει από την απομάκρυνση ενός υδρογόνου Άλφα από αυτό το ανιόν με καρβοξυλικό. Αυτό παράγει Άλφα,-ακόρεστο οξύ όταν οξινίζεται.
Για παράδειγμα, παρουσία οξικού νατρίου, το PhCHO αντιδρά με περίσσεια οξικού ανυδρίτη για να παράγει κινναμωμικό οξύ, το οποίο στη συνέχεια οξινίζεται (3-φαινυλοπροπανοϊκό οξύ).
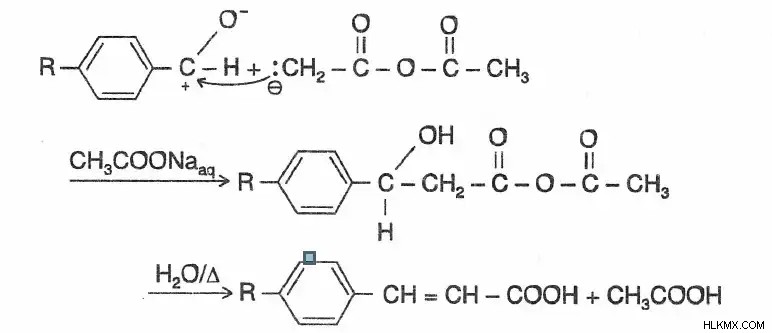
Μηχανισμός συμπύκνωσης Perkin
Το οξικό ιόν βρίσκεται εκεί για να εξαγάγει ένα πρωτόνιο από τον άνθρακα του ανυδρίτη, σχηματίζοντας ένα καρβανιόν που στη συνέχεια επιτίθεται στην καρβονυλική ομάδα της αλδεΰδης. Στη συνέχεια, το προϊόν αφαιρεί ένα πρωτόνιο από το οξύ για να δημιουργήσει ένα μόριο τύπου αλδόλης. Παρουσία θερμαινόμενου οξικού ανυδρίτη, ο τελευταίος αφυδατώνεται.
Παράδειγμα αντίδρασης Perkin
Η νιτροομάδα που αποσύρει ηλεκτρόνια υπάρχει στην 4-νιτροβενζαλδεΰδη. Κάνει τον καρβονυλικό άνθρακα πιο θετικά φορτισμένο. Ως αποτέλεσμα, στην αντίδραση συμπύκνωσης Perkins, η 4-νιτροβενζαλδεΰδη είναι η πιο αντιδραστική προς το πυρηνόφιλο. Το θετικό φορτίο στον άνθρακα καρβονυλίου μειώνεται όταν υπάρχουν ομάδες απελευθέρωσης ηλεκτρονίων σε αρωματικές αλδεΰδες. Ως αποτέλεσμα, τέτοιες ενώσεις είναι λιγότερο αντιδραστικές στα πυρηνόφιλα στην αντίδραση συμπύκνωσης Perkins.
Τι είναι ο μηχανισμός αντίδρασης;
Ένας μηχανισμός αντίδρασης στη χημεία είναι η βήμα προς βήμα ακολουθία στοιχειωδών αντιδράσεων που οδηγεί σε ολική χημική αλλαγή. Ένας χημικός μηχανισμός είναι μια θεωρητική υπόθεση που προσπαθεί να ορίσει λεπτομερώς τι συμβαίνει σε κάθε στάδιο μια χημική διαδικασία. Στις περισσότερες περιπτώσεις, οι συγκεκριμένες διαδικασίες μιας αντίδρασης δεν είναι ορατές. Ο προτεινόμενος μηχανισμός επιλέχθηκε επειδή είναι θερμοδυναμικά εφικτός και έχει πειραματική υποστήριξη σε απομονωμένα ενδιάμεσα (βλ. παρακάτω ενότητα) ή άλλες ποσοτικές και ποιοτικές ιδιότητες της αντίδρασης. Καθορίζει επίσης ποιοι δεσμοί σπάνε (και με ποια σειρά) και ποιοι δεσμοί δημιουργούνται για κάθε αντιδραστικό ενδιάμεσο, ενεργοποιημένο σύμπλοκο και κατάσταση μετάβασης (και με ποια σειρά). η στερεοχημεία που παρατηρείται στα αντιδρώντα και τα προϊόντα, τα προϊόντα που παράγονται και οι ποσότητες του καθενός.
Ενδιάμεσα αντιδράσεων
Τα ενδιάμεσα αντιδράσεων είναι χημικές οντότητες που δεν είναι αντιδρώντα ή προϊόντα της συνολικής χημικής αντίδρασης, αλλά είναι παροδικά προϊόντα ή/και αντιδρώντα στα στάδια αντίδρασης του μηχανισμού. Συχνά είναι ασταθή και βραχύβια (αν και μερικές φορές μπορεί να χωριστούν). Οι ελεύθερες ρίζες ή τα ιόντα χρησιμοποιούνται συχνά ως ενδιάμεσα αντιδράσεων. Η κινητική (σχετικοί ρυθμοί των σταδίων αντίδρασης και η εξίσωση του συνολικού ρυθμού) εξηγούνται ως προς την ενέργεια που απαιτείται για τη μετατροπή των αντιδρώντων στις προτεινόμενες μεταβατικές καταστάσεις (μοριακές καταστάσεις που αντιστοιχεί στα μέγιστα στις συντεταγμένες της αντίδρασης και στα σημεία σέλας στην επιφάνεια δυναμικής ενέργειας για την αντίδραση).
Συμπέρασμα
Ένας σωστός μηχανισμός αντίδρασης είναι ένα κρίσιμο στοιχείο της ακριβούς προγνωστικής μοντελοποίησης. Λεπτομερείς μηχανισμοί για πολλά συστήματα καύσης και πλάσματος είτε δεν είναι διαθέσιμοι είτε πρέπει να αναπτυχθούν. Ακόμη και όταν οι πληροφορίες είναι προσβάσιμες, η ανακάλυψη και η συλλογή σχετικών δεδομένων από πολλές πηγές, η συμφωνία ασύμφωνων αριθμών και η παρέκταση σε νέες συνθήκες μπορεί να είναι δύσκολη χωρίς τη βοήθεια ειδικών. Οι σταθερές ρυθμού και τα θερμοχημικά δεδομένα δεν είναι συχνά διαθέσιμα στη βιβλιογραφία, γεγονός που απαιτεί τη χρήση τεχνικών υπολογιστικής χημείας ή μεθόδων αθροιστικής ομάδας για να ληφθούν οι απαιτούμενες παραμέτρους. Τα εργαλεία υπολογιστικής χημείας μπορούν επίσης να χρησιμοποιηθούν για τον υπολογισμό των επιφανειών δυνητικής ενέργειας για αντιδράσεις και τον εντοπισμό πιθανών διεργασιών.
Σχετικές σελίδες
| Ειδοποιήσεις JEE | Υλικό μελέτης JEE |
| Διαφορά μεταξύ JEE | Σημαντικές φόρμουλες JEE |
| Συμβουλές για τις εξετάσεις JEE | Πλήρες φόρμες JEE |
| Μέσες τετραγωνικές ταχύτητες ρίζας | Τύπος ακτινωτών και γωνιακών κόμβων |
| Μαγνητικές ιδιότητες των στοιχείων d-Block | Περιορισμοί της θεωρίας του Arrhenius |
| Η εξίσωση Nernst και οι εφαρμογές της | Θεωρίες γαλακτωματοποίησης |




