Οξύ HCl (Υδροχλωρικό Οξύ) – Δομή, Ιδιότητες, Παρασκευάσματα &Χρήσεις
Το υδροχλωρικό οξύ είναι μια ανόργανη ένωση που περιέχει υδρογόνο και χλώριο. Είναι ένα διαβρωτικό οξύ. Το υδροχλωρικό οξύ ονομάζεται επίσης υδροχλώριο ή μουριατικό οξύ. Τόσο το υδροχλωρικό οξύ όσο και το υδροχλώριο μοιράζονται τον ίδιο μοριακό τύπο, το HCl, καθώς είναι η ίδια ένωση. Ωστόσο, διαφέρουν στις πολιτείες. Το υδροχλώριο εμφανίζεται με τη μορφή αερίου σε θερμοκρασία και πίεση δωματίου. Όταν το αέριο υδροχλώριο διαλύεται στο νερό, δίνει HCl οξύ. Έτσι, για να διαφοροποιηθούν τα δύο, γράφεται ένας δείκτης που απεικονίζει την κατάσταση της ύλης με τον χημικό τύπο — HCl(g) και HCl(aq). Το παρακάτω άρθρο εξερευνά τη χημεία του HCl λεπτομερώς.
Δομή του HCl
Το υδροχλώριο ή το υδροχλωρικό οξύ είναι ένα απλό διατομικό μόριο όπου τα δύο άτομα - υδρογόνο και χλώριο, συγκρατούνται μεταξύ τους με έναν μόνο ομοιοπολικό δεσμό. Ο δεσμός είναι πολικός επειδή το άτομο του χλωρίου είναι πιο ηλεκτραρνητικό από το άτομο του υδρογόνου. Ενώ η ηλεκτραρνητικότητα του χλωρίου είναι 3,16, το υδρογόνο έχει ηλεκτραρνητικότητα 2,2.
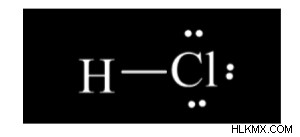
Lewis Structure of hydrochloric Acid
Η ένωση περιέχει
- Ένα άτομο υδρογόνου και ένα άτομο χλωρίου. Είναι διατομικό.
- Έχει έναν απλό δεσμό ή ένα ζεύγος ηλεκτρονίων σύνδεσης.
- Έχει τρία ζεύγη μη δεσμευτικών ηλεκτρονίων.
Το υδροχλώριο διαλύεται εύκολα στο νερό γιατί:
- Τόσο το υδρογόνο όσο και το νερό είναι πολικής φύσης λόγω της διαφοράς στην ηλεκτραρνητικότητα των ατόμων τους.
- Το HCl έχει την ικανότητα να διασπάται σε ιόντα. Έτσι, το μόριο του νερού τραβά τα ιόντα υδρογόνου από τα ιόντα χλωρίου.
Παρασκευή υδροχλωρικού οξέος – HCl
Η ακόλουθη μέθοδος για την παρασκευή υδροχλωρικού οξέος είναι δημοφιλής στα εργαστήρια καθώς και για την παρασκευή υδροχλωρίου εμπορικής κλίμακας. Σε αυτή τη μέθοδο, το χλωριούχο νάτριο είναι φωλιασμένο με ζεστό και συμπυκνωμένο θειικό οξύ.
NaCl + H2 SO4 → NaHSO4 + HCl
NaHSO4 + NaCl → Na2 SO4 + HCl
Ιδιότητες του υδροχλωρικού οξέος
Το υδροχλωρικό οξύ είναι ένα έντονα όξινο, άχρωμο και παχύρρευστο υγρό με μια χαρακτηριστική πικάντικη μυρωδιά. Η ευδιάκριτη μυρωδιά του καθιστά εύκολη την αναγνώριση στα εργαστήρια. Το HCl χρησιμοποιείται στην επεξεργασία δέρματος και στην παραγωγή ζελατίνης. Οι περισσότερες από τις φυσικές ιδιότητες του HCl, όπως η πυκνότητα, το pH, το σημείο τήξης και το σημείο βρασμού, εξαρτώνται από τη μοριακή του συγκέντρωση.
Μερικές σημαντικές ιδιότητες του HCl αναφέρονται παρακάτω:
- Μοριακό βάρος/ Μοριακή μάζα:36,458 g/mol
- Οσμή:Πικάντικη μυρωδιά
- Εμφάνιση:Διαφανές υγρό
- Σημείο βρασμού:Εξαρτάται από τη συγκέντρωση
- Σημείο τήξης:Εξαρτάται από τη συγκέντρωση
Χημικές ιδιότητες του HCl
Το αέριο υδροχλώριο σχηματίζει εύκολα χλωρίδια με ενεργά μέταλλα, τα ανθρακικά, τα οξείδια και τα υδροξείδια τους. Οι αντιδράσεις γίνονται κυρίως παρουσία υγρασίας.
Το υδροχλωρικό οξύ αντιδρά με μέταλλα και εκτοπίζει το αέριο υδρογόνο. Όταν αντιδρά με απλά οξείδια (μετάλλων) και υδροξείδια, σχηματίζει χλωριούχο μέταλλο και νερό – η κοινή αντίδραση εξουδετέρωσης.
Οξείδωση HCl
Το HCl αντιδρά με υπερμαγγανικό κάλιο ή διχρωμικό κάλιο για να απελευθερώσει αέριο χλώριο.
2KMnO4 + 16 HCl → 2 KCl + 2 MnCl2 + 5 Cl2 + 8 H2 O
2K2 Cr2 O7 + 14 HCl → 2 KCl + 2 CrCl3 + 3 Cl2 + 7 H2 O
Αντίδραση με ανθρακικά άλατα
Το υδροχλωρικό οξύ αντιδρά με ανθρακικά άλατα και παράγει διοξείδιο του άνθρακα.
Na2 CO3 + 2 HCl → 2 NaCl + H2 O + CO2
Αντίδραση με διττανθρακικά
Το υδροχλωρικό οξύ αντιδρά με όξινα ανθρακικά άλατα για να δώσει διοξείδιο του άνθρακα.
NaHCO3 + HCl → NaCl + H2 O + CO2
Αντίδραση με θειώδη άλατα
Το υδροχλωρικό οξύ αντιδρά με τα θειώδη για να δώσει αέριο διοξείδιο του θείου.
Na2 SO3 + 2 HCl → 2 NaCl + H2 O + SO2
Σχηματισμός Aqua Regia
Όταν το πυκνό υδροχλωρικό οξύ και το πυκνό ΗΝΟ3 συνδυάζονται σε αναλογία 3:1, σχηματίζεται aqua regia. Αυτό το μείγμα μπορεί να διαλύσει μέταλλα όπως η πλατίνα και ο χρυσός για να σχηματίσει τα αντίστοιχα χλωρίδια τους.
Διάσταση του HCl
Το HCl είναι ένα ισχυρό οξύ. Αλλά τι εννοείτε με ισχυρό οξύ;
Σύμφωνα με τον Arrhenius, ένα οξύ είναι μια ουσία που σχηματίζει ιόντα υδρογόνου ή πρωτόνια κατά τη διάσπαση.
Η ευκολία και η ποσότητα της απελευθέρωσης ιόντων υδρογόνου καθιστούν το οξύ ισχυρό ή αδύναμο. Το HCl κατηγοριοποιείται ως πολύ ισχυρό οξύ επειδή διασπάται στο νερό. Έτσι, ως δότης πρωτονίων, το HCl ικανοποιεί όλα τα χαρακτηριστικά ενός οξέος. Χρησιμεύει ως βάση μόνο όταν είναι αποδέκτης πρωτονίων, και αυτό συμβαίνει όταν αντιδρά με μια σταθερή ουσία υψηλότερης διάστασης οξέος ή ένα υπεροξύ. Η υδατική μορφή του υδροχλωρίου είναι επίσης όξινη. Η αντίδραση διάστασης φαίνεται στην ακόλουθη εξίσωση:
HCl + H2 O → H3 O + Cl
Χρήσεις HCl
Νωρίτερα, το υδροχλωρικό οξύ διαλύθηκε σε υγρά και απορρίφθηκε στους ωκεανούς καθώς οι βιομηχανικές του χρήσεις δεν απελευθερώθηκαν. Αργότερα, με την πρόοδο της επιστημονικής μελέτης, εμφανίστηκαν σημαντικές χρήσεις βιομηχανικών χρήσεων, συμπεριλαμβανομένων των
Παραγωγή Οργανικών Ενώσεων
Χρησιμοποιείται στην παραγωγή οργανικών ενώσεων όπως το διχλωρομεθάνιο ή το χλωριούχο βινύλιο, τα πλαστικά, η δισφαινόλη Α και άλλα.
Παραγωγή ανόργανων ενώσεων
Είναι χρήσιμο στην παρασκευή ενώσεων που χρησιμοποιούνται για επεξεργασία νερού. Το αλουμίνιο και το υδροχλωρικό οξύ χρησιμοποιούνται στην παραγωγή πολυχλωριούχου αλουμινίου (PAC), υδατάνθρακα αλουμινίου και χλωριούχου σιδήρου (III) για επεξεργασία νερού.
Χρησιμοποιείται επίσης στην αναγέννηση ρητινών ανταλλαγής ιόντων. Χρησιμοποιείται επίσης για το ξέπλυμα των κατιόντων ρητίνης.
Για τον καθαρισμό επιτραπέζιου αλατιού
Το HCl είναι δημοφιλές για τον καθαρισμό επιτραπέζιων αλάτων. Επιπλέον, χρησιμοποιείται επίσης για τη ρύθμιση της οξύτητας (pH) των διαλυμάτων. Το HCl είναι αποτελεσματικό στον έλεγχο του pH των τροφίμων, των φαρμακευτικών προϊόντων και του νερού.
Αφαίρεση μεταλλικών λεκέδων
Το υδροχλωρικό οξύ χρησιμεύει ως ισχυρό χημικό για την αφαίρεση σκουριάς ή λεκέδων από σίδηρο, χαλκό και άλλα μέταλλα. Ωστόσο, η αραιωμένη του μορφή χρησιμοποιείται για σκοπούς καθαρισμού, όπως πλακάκια σε μπάνια και κουζίνες.
Χρησιμοποιείται επίσης ως απολυμαντικό ή στην κλωστοϋφαντουργία για λεύκανση ρούχων, επεξεργασία δέρματος και άλλα.
Για την παραγωγή πετρελαίου
Το HCl χρησιμοποιείται στην παραγωγή λαδιού. Είναι ένα πέτρωμα που οδηγεί σε σχηματισμό δομής μεγάλων πόρων λόγω των αντιδράσεων που βοηθούν στην παραγωγή λαδιού.
Άλλες χρήσεις
- Κατασκευή κόλλας και ζελατίνης
- Παραγωγή γλυκόζης και ζάχαρης καλαμποκιού από άμυλο
- Κατασκευή πλαστικών και συνθετικού καουτσούκ
- Διυλίωση ζάχαρης από ζαχαροκάλαμο
- Κατασκευή aqua regia για διάλυση χρυσού και πλατίνας
- Χρησιμοποιείται στη διαδικασία παραγωγής χλωρίου.
- Για την παραγωγή λιπασμάτων.
- Στις βιομηχανίες κλωστοϋφαντουργίας και την κατασκευή βαφών
- Για τον καθαρισμό μετάλλων
- Για να ρυθμίσετε το PH των διαλυμάτων
Βρίσκεται υδροχλωρικό οξύ στο ανθρώπινο σώμα;
Τα κοιλιακά βρεγματικά κύτταρα δημιουργούν HCl στο σώμα. Η διαδικασία περιλαμβάνει ενέργεια ATP για την ανταλλαγή ιόντων καλίου που υπάρχουν στο στομάχι με τα ιόντα υδρογόνου των βρεγματικών κυττάρων. Κατά συνέπεια, τόσο ιόντα υδρογόνου όσο και χλωρίου εμφανίζονται στον αυλό του στομάχου.
Η έκκριση του στομάχου περιλαμβάνει διάφορα ένζυμα και υδροχλωρικό οξύ. Η επικάλυψη βλέννας προστατεύει το βλεννογόνο του στομάχου από τις βλαβερές συνέπειες του HCl.
Το HCl στο στομάχι συμμετέχει στη διάσπαση των τροφών και τις αφομοιώνει. Ο γαστρικός χυμός περιέχει υδροχλωρικό οξύ που διασπά τις πρωτεΐνες. Επίσης, σκοτώνει τα βακτήρια στο στομάχι και εξαλείφει τους ιούς, προστατεύοντας έτσι το ανθρώπινο σώμα από λοιμώξεις.
Η συγκέντρωση του υδροχλωρικού οξέος στο στομάχι είναι 0,5 τοις εκατό. Το ισορροπημένο pH του στομάχου είναι περίπου 1,0-2,0. Το χαμηλό pH του στομάχου το καθιστά απαλλαγμένο από μικρόβια.
Υδροχλωρικό οξύ στο δέρμα
Είναι σημαντικό να κατανοήσουμε ότι το υδροχλωρικό οξύ που υπάρχει στο στομάχι είναι πολύ ήπιο σε συγκέντρωση και το υδροχλωρικό οξύ στα εργαστήρια είναι αρκετά ισχυρό. Επομένως, πρέπει να είστε πολύ προσεκτικοί όταν χρησιμοποιείτε υδροχλωρικό οξύ.
Εάν έρθουν σε επαφή χαμηλές συγκεντρώσεις αερίου HCl ή υδροχλωρικού οξέος με το δέρμα, προκαλείται ερύθημα και φλεγμονή. Ωστόσο, οι υψηλές συγκεντρώσεις μπορεί να οδηγήσουν σε χημικά εγκαύματα στο δέρμα και ακόμη και στους βλεννογόνους κατά την εισπνοή.
Εάν τύχει να ρίξετε πυκνό υδροχλωρικό οξύ στο δέρμα σας, πρέπει να λάβετε αμέσως τα ακόλουθα μέτρα:
- Ξεπλύνετε την πληγείσα περιοχή με καθαρό νερό το συντομότερο δυνατό.
- Πρέπει να βεβαιωθείτε ότι το νερό τρέχει από την πληγείσα περιοχή και δεν λιμνάζει στο δέρμα.
- Επίσης, δεν πρέπει να προσπαθήσετε να τρίψετε ή να σκουπίσετε την περιοχή.
Συμπέρασμα
Το υδροχλωρικό οξύ είναι το υδατικό διάλυμα υδροχλωρίου. Είναι ένα διαβρωτικό αλλά χρήσιμο χημικό που βρίσκει εφαρμογές σε διάφορες βιομηχανίες. Το HCl υπάρχει φυσικά στο σώμα μας με τη μορφή γαστρικού HCl, το οποίο έχει συγκέντρωση 0,5%.
Συχνές ερωτήσεις
1. Ποια είναι η πιο δημοφιλής χρήση του υδροχλωρικού οξέος;
Α. Το υδροχλωρικό οξύ είναι ένα ισχυρό χημικό αντιδραστήριο για την παραγωγή πολυβινυλοχλωριδίου για πλαστικά. Χρησιμοποιείται συχνά για τον καθαρισμό και την απολύμανση των νοικοκυριών. Το αραιωμένο HCl βοηθά στην αφαλάτωση των περιοχών. Χρησιμοποιείται στην επεξεργασία ζελατίνης και επίσης ως πρόσθετο τροφίμων στη βιομηχανία τροφίμων.
2. Πώς θα εξουδετερώνατε το υδροχλωρικό οξύ;
Α. Οι ισχυρές βάσεις αντιδρούν με το υδροχλωρικό οξύ για να δώσουν μια αντίδραση εξουδετέρωσης που παράγει αλάτι και νερό. Μπορείτε να χρησιμοποιήσετε διττανθρακικό νάτριο ή μαγειρική σόδα στην περιοχή της διαρροής υδροχλωρικού οξέος για να εξουδετερώσετε το οξύ. Βάλτε αρκετή μαγειρική σόδα πριν αρχίσει να αφρίζει. Το εξουδετερωμένο υδροχλωρικό οξύ μπορεί στη συνέχεια να ξεπλυθεί χρησιμοποιώντας υπερβολικές ποσότητες νερού.
3. Το υδροχλωρικό οξύ είναι αδύναμο ή ισχυρό;
Α. Βαρέα οξέα είναι αυτά που διασπώνται πλήρως στα ιόντα τους. Αντίθετα, τα αδύναμα οξέα διασπώνται μερικώς. Το θειικό οξύ, το υδροχλωρικό οξύ και το νιτρικό οξύ είναι μερικά από τα πιο δημοφιλή ισχυρά οξέα.
4. Τι είναι το Hydrochloride;
Α. Υδροχλωρικό είναι το προϊόν που λαμβάνεται όταν το υδροχλωρικό οξύ αντιδρά με μια οργανική βάση. Μια οργανική βάση είναι ένας υδρογονάνθρακας που χρησιμεύει ως βάση ή ως αποδέκτης πρωτονίων. Μερικά παραδείγματα οργανικών βάσεων είναι τα εξής:
- Πυριδίνη C5 H5 N
- Μεθυλαμίνη CH3 NH2
Βενζιμιδαζόλη C7 H6 N2