Υβριδισμός ιόντων τριιωδιδίου
Στοιχεία που είναι ασταθή συνδυάζονται συνήθως με άλλα στοιχεία είτε χάνοντας είτε κερδίζοντας είτε μοιράζοντας ηλεκτρόνια. Αυτό λέγεται ότι είναι χημικός δεσμός. Συνήθως, τα στοιχεία συνδυάζονται με άλλα στοιχεία μόνο με τη βοήθεια ηλεκτρονίων σθένους. Τα ηλεκτρόνια σθένους είναι αυτά που υπάρχουν στο εξώτατο κέλυφος ενός ατόμου. Αυτά είναι μακριά από τον πυρήνα και μπορούν εύκολα να εμπλακούν στη σύνδεση με άλλα στοιχεία.
Ο υβριδισμός είναι το φαινόμενο που περιλαμβάνει την ανάμειξη ατομικών τροχιακών του κεντρικού ατόμου που διαφέρουν σε ενέργεια και την ανακατανομή τους σε ίσο αριθμό υβριδικών τροχιακών ίσου σχήματος και ενέργειας. Ο υβριδισμός συμβαίνει μόνο στο κεντρικό άτομο. Σε ένα ομοιοπολικό μόριο, το στοιχείο με υψηλό σθένος θεωρείται το κεντρικό άτομο.
Σκοπός υβριδισμού
Ο υβριδισμός συμβαίνει σε ομοιοπολικά μόρια και μεταξύ των ατομικών τροχιακών του κεντρικού ατόμου. Ο υβριδισμός δεν συμβαίνει σε όλα τα ομοιοπολικά μόρια και συμβαίνει σε ετεροατομικά μόρια όπως το μεθάνιο, η αμμωνία κ.λπ. Ο υβριδισμός συμβαίνει στο κεντρικό άτομο, όπου τα ηλεκτρόνια στο κέλυφος σθένους υπάρχουν σε τροχιακά διαφορετικής ενέργειας και σχήματος.
Σημασία του υβριδισμού
Ο υβριδισμός συμβαίνει στο κεντρικό άτομο για να ληφθούν τα τροχιακά ίσης ενέργειας και η επικάλυψη τροχιακών με ίση ενέργεια είναι αποτελεσματική. Ο υβριδισμός βοηθά στη γνώση των τύπων δεσμών που σχηματίζονται μεταξύ των δύο στοιχείων. Οι δεσμοί που σχηματίζονται μεταξύ των ατόμων με ομοιοπολικό δεσμό μπορεί να είναι δύο τύπων:δεσμός σίγμα και δεσμός π.
Δεσμός σίγμα:Ο δεσμός σίγμα είναι ένας ομοιοπολικός δεσμός που σχηματίζεται από την κοινή χρήση ηλεκτρονίων που υπάρχουν στα τροχιακά. Ο τύπος της επικάλυψης που παρατηρείται μεταξύ των τροχιακών είναι η μετωπική επικάλυψη ή η διαξονική επικάλυψη. Αυτός ο τύπος αλληλεπικάλυψης οδηγεί σε ισχυρή επικάλυψη τροχιακών και ως εκ τούτου ισχυρότερο δεσμό, ο οποίος είναι ένας σταθερός δεσμός με ελάχιστη ενέργεια.
Δεσμός Pi:Ο δεσμός Pi είναι ένας ομοιοπολικός δεσμός που σχηματίζεται από την κοινή χρήση ηλεκτρονίων που υπάρχουν στα τροχιακά. Ο τύπος της επικάλυψης που παρατηρείται μεταξύ των τροχιακών είναι πλάγια επικάλυψη ή παράλληλη επικάλυψη. Η πλάγια επικάλυψη οδηγεί σε ασθενέστερο δεσμό με υψηλή ενέργεια και λιγότερη σταθερότητα.
Ο δεσμός Sigma είναι ισχυρότερος δεσμός και μπορεί να υπάρχει ανεξάρτητα, αλλά ο δεσμός pi είναι πιο αδύναμος και δεν μπορεί να υπάρξει ανεξάρτητα.
Υβριδισμός σε ιόν τριιωδιδίου
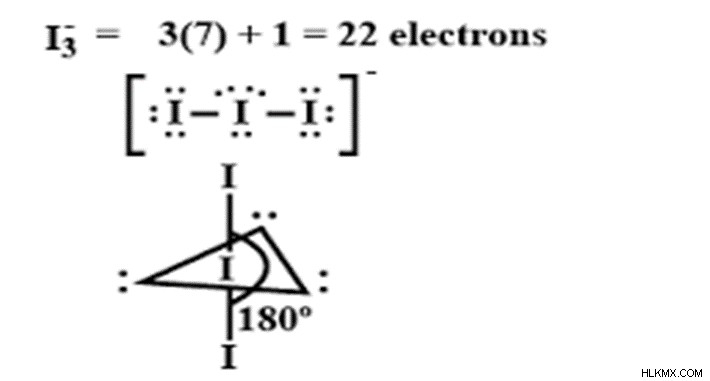
Το ιόν τριιωδιδίου είναι η ένωση ιωδίου με τον τύπο (I3-). Το όνομα της ένωσης τελειώνει με τον όρο -ide, που σημαίνει ότι είναι μια δυαδική ένωση και ένα ανιόν. Αυτό το ιόν είναι γραμμικό και συμμετρικό. Σε αυτήν την ένωση, το ιώδιο είναι το κεντρικό άτομο και έχει επτά ηλεκτρόνια στο εξωτερικό του περίβλημα.
I – ατομικός αριθμός- 53
Ηλεκτρονική διαμόρφωση Valence – [Kr] 4d10 5s2 5p5
Το ιώδιο ανήκει στην οικογένεια των αλογόνου και έχει ένα ηλεκτρόνιο λιγότερο από την οκτάδα. Το ιώδιο χρησιμοποιεί και τα επτά ηλεκτρόνια που υπάρχουν σε τροχιακά 5s, 5p και 4d για να σχηματίσει τα υβριδικά τροχιακά. Το I3- είναι ένα γραμμικό ιόν που σχηματίζεται από το συνδυασμό του μορίου I2 με το μειόν στο οποίο το μόριο I2 δρα ως δέκτης και το I- ως δότης ηλεκτρονίων. Ο υβριδισμός που το I3- υφίσταται υβριδισμό sp3.
Ο τύπος για τον υπολογισμό του υβριδισμού του στοιχείου:
Αριθμός υβριδισμού =ηλεκτρόνια σθένους + μονοσθενή άτομα + (αρνητικό φορτίο) – (θετικό φορτίο)/2
=7+ 2 + 1- 0/2 =10/2 =5
Αν ο αριθμός υβριδισμού είναι ίσος με 5, τότε ο υβριδισμός είναι sp3d.
Σύμφωνα με τη θεωρία VSEPR (απώθηση ζεύγους ηλεκτρονίων φλοιού σθένους), ο αριθμός για τον υβριδισμό μπορεί να υπολογιστεί από το άθροισμα των ζευγών δεσμών και των μονών ζευγών. Στο I3-, ο αριθμός των ζευγών δεσμών γύρω από το I είναι δύο και ο αριθμός των μοναχικών ζευγών είναι 3. Άρα, το άθροισμα των μοναχικών ζευγών και των ζευγών δεσμών είναι 2 + 3 =5, που είναι υβριδισμός sp3d. Για τον υβριδισμό sp3d, η αναμενόμενη γεωμετρία είναι τριγωνική διπυραμιδική γεωμετρία όταν υπάρχουν 5 ζεύγη δεσμών. Στα ιόντα τριιωδιδίου, υπάρχουν μοναχικά ζεύγη καθώς και ζεύγη δεσμών. Σύμφωνα με τη θεωρία VSEPR, τα ζεύγη ηλεκτρονίων που υπάρχουν στο φλοιό σθένους υφίστανται απώθηση. Τα απωθημένα μπορεί να είναι μεταξύ ζευγών δεσμών, μοναχικών ζευγών και ζευγών μοναχικού δεσμού. Οι απωθήσεις ζεύγους δεσμού-δεσμού είναι λιγότερο ισχυρές και μπορούν να παρουσιάσουν αύξηση της γωνίας δεσμού καθώς οι δεσμοί απομακρύνονται. Οι απωθήσεις μοναχικού ζεύγους-μοναχικού ζεύγους είναι ισχυρές και προκαλούν μείωση της γωνίας δεσμού. Οι αποκρούσεις ζεύγους μοναχικού ζεύγους-δεσμού είναι ισχυρές αλλά λιγότερες από τις αποκρούσεις μοναχικού ζεύγους – μοναχικού ζεύγους. Η σειρά των αποκρούσεων είναι
Ζεύγος δεσμών- απωθήσεις ζεύγους δεσμών<αποκρούσεις ζεύγους μοναχικού ζεύγους-απωθήσεις ζεύγους μοναχικού ζεύγους
Στα ιόντα τριιωδιδίου, υπάρχουν απωθήσεις μοναχικού ζεύγους-μονικού ζεύγους, απωθήσεις ζεύγους μοναχικού ζεύγους-δεσμού και απωθήσεις ζεύγους δεσμού δεσμού. Έτσι, το μόριο αποκλίνει από την αρχική γεωμετρία, σχήμα και γωνία δεσμού. Η αναμενόμενη γεωμετρία είναι τριγωνική διπυραμιδική και το σχήμα που επιτυγχάνεται είναι γραμμικό. Η αναμενόμενη γωνία δεσμού για τον υβριδισμό sp3d είναι 120 και 90, αλλά λόγω του γραμμικού σχήματος, η γωνία δεσμού του είναι 180.
Συμπέρασμα
Ιωνικός δεσμός είναι ο δεσμός που λαμβάνει χώρα όταν τα στοιχεία συνδυάζονται χάνοντας ηλεκτρόνια ή κερδίζοντας ηλεκτρόνια, δηλαδή μέσω της μεταφοράς ηλεκτρονίων. Αυτός ο τύπος σύνδεσης συμβαίνει μεταξύ στοιχείων με διαφορετική ηλεκτραρνητικότητα ή μεταξύ ενός μετάλλου και ενός μη μετάλλου. Στοιχεία με σχεδόν την ίδια ηλεκτραρνητικότητα ή με μικρότερη διαφορά ηλεκτραρνητικότητας σχηματίζουν ομοιοπολικούς δεσμούς με κοινή χρήση ηλεκτρονίων.




