Παραδείγματα δεσμών υδρογόνου
Το υδρογόνο είναι το πρώτο στοιχείο του περιοδικού πίνακα. Είναι ένα άοσμο, άγευστο και άχρωμο αέριο υπό κανονικές συνθήκες. Αποτελείται από διατομικά μόρια Η2 και αντιπροσωπεύεται από το σύμβολο Η. Με τον ατομικό αριθμό ένα, το υδρογόνο αποτελείται από ένα ηλεκτρόνιο και ένα πρωτόνιο. Ο δεσμός υδρογόνου περιγράφεται ως η ηλεκτροστατική επαφή δίπολου προς δίπολο που λαμβάνει χώρα μεταξύ μορίων που μοιράζονται πολλά χαρακτηριστικά ομοιοπολικού δεσμού. Δεδομένου ότι ο δεσμός υδρογόνου είναι σχετικά ισχυρότερος, οδηγεί σε μικρότερο αριθμό εταίρων αλληλεπίδρασης. Για παράδειγμα, στην περίπτωση των μορίων νερού, που χημικά αντιπροσωπεύονται ως (H2O), το υδρογόνο συνδέεται ομοιοπολικά με το ηλεκτραρνητικό άτομο οξυγόνου.
Σήμερα, θα συζητήσουμε λεπτομερώς την έννοια του δεσμού υδρογόνου, παραδείγματα δεσμών υδρογόνου και άλλα σχετικά θέματα. Λοιπόν, χωρίς άλλη καθυστέρηση, ας ξεκινήσουμε!
Δεσμός υδρογόνου
Ο δεσμός υδρογόνου είναι η σύνθεση του δεσμού υδρογόνου που είναι ο τύπος διαμοριακής δύναμης που προκαλείται από την αλληλεπίδραση διπόλου-διπόλου μεταξύ ατόμων υδρογόνου και άκρως ηλεκτραρνητικά άτομα. Σε σύγκριση με τον ομοιοπολικό ή ιοντικό δεσμό, ο δεσμός υδρογόνου είναι γενικά πιο αδύναμος. Ωστόσο, είναι ισχυρότερο από τις δυνάμεις Van Der Waals. Οι ειδικοί ταξινόμησαν τους δεσμούς υδρογόνου ως έναν τύπο αδύναμου χημικού δεσμού.
Παραδείγματα δεσμών υδρογόνου
Ακολουθούν μερικά παραδείγματα της σημασίας του δεσμού υδρογόνου –
Νερό – Το εξαιρετικά ηλεκτραρνητικό άτομο οξυγόνου συνδέεται με το άτομο υδρογόνου σε ένα μόριο νερού. Τα κοινά ζεύγη του ηλεκτρονίου έλκονται στενά από τα άτομα του οξυγόνου και γι' αυτό το άκρο του μορίου γίνεται αρνητικό, ενώ τα άτομα υδρογόνου φαίνονται θετικά.
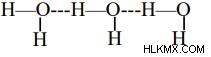
Υδροφθόριο – Στους δεσμούς υδρογόνου, το φθόριο σχηματίζει τον ισχυρότερο δεσμό υδρογόνου με την υψηλότερη ηλεκτραρνητικότητα.
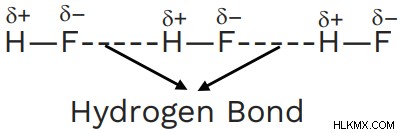
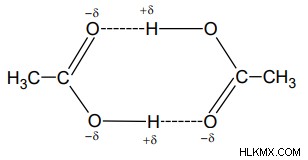
Δεσμός υδρογόνου σε καρβοξυλικό οξύ και αλκοόλες – Το αλκοόλ αναφέρεται ως οργανικό μόριο με ομάδα -ΟΗ. Γενικά, σε περίπτωση που οποιοδήποτε μόριο έχει άτομο υδρογόνου είτε συνδέεται απευθείας με άζωτο είτε με οξυγόνο. Αργότερα, ο δεσμός υδρογόνου γίνεται ευκολότερος.
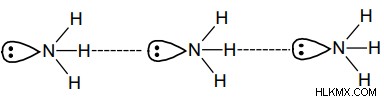
Δεσμός υδρογόνου στην αμμωνία – Έχει άζωτο ηλεκτραρνητικού ατόμου συνδεδεμένο με άτομα υδρογόνου.
Δεσμός υδρογόνου στο πολυμερές – Προκειμένου να προσδιοριστούν οι τρισδιάστατες δομές και οι ιδιότητες που αποκτώνται από φυσικές και συνθετικές πρωτεΐνες, ο δεσμός υδρογόνου είναι ένας κρίσιμος παράγοντας. Παίζει επίσης σημαντικό ρόλο στον καθορισμό της δομής της κυτταρίνης μαζί με παράγωγα πολυμερή, συμπεριλαμβανομένου του λιναριού ή του βαμβακιού.
Τύποι δεσμών υδρογόνου με παραδείγματα
Υπάρχουν κυρίως δύο σημαντικοί τύποι δεσμών υδρογόνου (Η) μαζί με τα παραδείγματά τους. Αυτά περιλαμβάνουν –
-
Δεσμός διαμοριακού υδρογόνου
Σε περίπτωση που προκύπτει δεσμός υδρογόνου μεταξύ διαφορετικών μορίων που έχουν είτε τις ίδιες είτε διαφορετικές ενώσεις, αυτές αναφέρονται ως διαμοριακός δεσμός υδρογόνου. Συνήθη παραδείγματα διαμοριακών δεσμών υδρογόνου περιλαμβάνουν δεσμούς υδρογόνου σε αλκοόλη, νερό, αμμωνία και ούτω καθεξής.
Παράδειγμα:
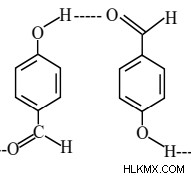
-
Ενδομοριακός δεσμός υδρογόνου
Ο ενδομοριακός δεσμός υδρογόνου μπορεί να περιγραφεί ως δεσμός υδρογόνου που συμβαίνει κυρίως μέσα στο μόριο μόνο. Αυτός ο τύπος δεσμού υδρογόνου λαμβάνει χώρα σε ενώσεις που έχουν δύο ομάδες. Από τις δύο ομάδες, μια ομάδα έχει άτομο υδρογόνου, ενώ μια άλλη ομάδα έχει ένα εξαιρετικά ηλεκτραρνητικό άτομο.
Παράδειγμα:
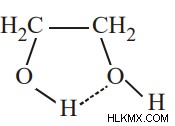
Συνθήκες για τον δεσμό υδρογόνου
Στο μόριο όπου το άτομο υδρογόνου είναι στενά συνδεδεμένο με το εξαιρετικά ηλεκτραρνητικό άτομο, το κοινό κομμάτι ενός ηλεκτρονίου έλκεται. Ως αποτέλεσμα, το άκρο του μορίου γίνεται ελαφρώς αρνητικό, ενώ το άλλο άκρο γίνεται θετικό. Και τα δύο άκρα ελκύουν το ένα το άλλο, γεγονός που οδηγεί στο σχηματισμό ενός αδύναμου δεσμού μεταξύ τους. Αυτός ο δεσμός αναφέρεται ως δεσμός υδρογόνου. Ακολουθούν δύο κύριες συνθήκες σύνδεσης υδρογόνου -
Κάθε μόριο θα πρέπει να έχει ένα εξαιρετικά ηλεκτραρνητικό άτομο συνδεδεμένο με το άτομο υδρογόνου. Όσο μεγαλύτερη θα είναι η ηλεκτραρνητικότητα, τόσο μεγαλύτερη είναι η πόλωση του μορίου.
Το ηλεκτραρνητικό μέγεθος του ατόμου πρέπει να είναι μικρό. Εάν το μέγεθος είναι μικρότερο, η ηλεκτροστατική έλξη θα είναι μεγαλύτερη.
Γιατί η ένωση με δεσμούς υδρογόνου έχει υψηλά σημεία τήξης και υψηλά σημεία βρασμού;
Οι ενώσεις που συνδέονται με υδρογόνο έχουν γενικά υψηλό σημείο βρασμού και τήξης. Αυτές οι υψηλές θερμοκρασίες των ενώσεων που συνδέονται με υδρογόνο ευθύνονται για περισσότερη ενέργεια που απαιτείται για τη διάσπαση αυτών των δεσμών.
Όταν βρίσκεται σε θερμοκρασία δωματίου, το H2O είναι υγρό. Ωστόσο, τα H2S, H2Se και H2Te βρίσκονται σε αέρια κατάσταση. Δεδομένου ότι ο δεσμός υδρογόνου δημιουργεί συνδέσμους στα μόρια του νερού, οδηγεί σε υψηλότερο σημείο βρασμού και τήξης σε σύγκριση με άλλες χημικές ουσίες.
Δεδομένου ότι υπάρχει δεσμός υδρογόνου στο NH3. Ωστόσο, δεν υπάρχει δεσμός υδρογόνου στο PH3. Η αμμωνία έχει υψηλό σημείο βρασμού.
Καθώς η αιθανόλη έχει δεσμούς υδρογόνου, το σημείο βρασμού της είναι υψηλότερο από τον διαιθυλαιθέρα.
Συμπέρασμα
Με αυτό, φτάνουμε στο τέλος του θέματος των παραδειγμάτων δεσμών υδρογόνου. Ο δεσμός υδρογόνου μπορεί να περιγραφεί ως η διαδικασία σχηματισμού δεσμών υδρογόνου που αποτελούν ειδική κατηγορία ελκτικής διαμοριακής δύναμης που προκύπτει λόγω της αλληλεπίδρασης διπόλου-διπόλου μεταξύ του ατόμου υδρογόνου και του εξαιρετικά ηλεκτραρνητικού ατόμου. Εμφανίζεται κυρίως μεταξύ ενός ηλεκτραρνητικού και ενός ατόμου υδρογόνου.
Οι ειδικοί ταξινόμησαν τους δεσμούς υδρογόνου ως έναν τύπο αδύναμου χημικού δεσμού. Μερικά από τα κοινά παραδείγματα της έννοιας του δεσμού υδρογόνου είναι ο δεσμός υδρογόνου στο υδροφθόριο, ο δεσμός υδρογόνου στο νερό, ο δεσμός υδρογόνου στην αμμωνία, ο δεσμός υδρογόνου στο πολυμερές και ούτω καθεξής, τα οποία συζητήσαμε λεπτομερώς. Περαιτέρω ταξινομείται σε δύο κύρια μέρη:Διαμοριακός δεσμός υδρογόνου και ενδομοριακός δεσμός υδρογόνου. Στο τελευταίο μέρος, αναφέραμε συνοπτικά τις ιδιότητες και τις συνθήκες του δεσμού υδρογόνου. Ελπίζουμε ότι αυτό βοήθησε στην καλύτερη κατανόηση της έννοιας του δεσμού υδρογόνου.




